
| A. | 1.08 g | B. | 1.28 g | C. | 2.16 g | D. | 4.32 g |
分析 惰性电极电解AgNO3的溶液,溶液中的阴离子向阳极移动,在阳极上放电,利用离子的放电顺序来确定阳极上产生的气体是氧气,根据电子守恒来确定阴极上析出金属银的量的多少.
解答 解:惰性电极电解AgNO3的溶液,阳极上的反应为:4OH-→4H2O+O2↑+4e-,当阳极上产生的气体的物质的量为0.0100mol,转移电子是:0.0400mol,阴极上的电极反应为:Ag++e-═Ag,当转移电子是0.0400mol时,析出Ag的质量m=0.0400mol×108g/mol=4.32g.
故选D.
点评 本题考查学生电解池的工作原理知识,注意电子守恒思想在解题中的应用,可以根据教材知识来回答,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
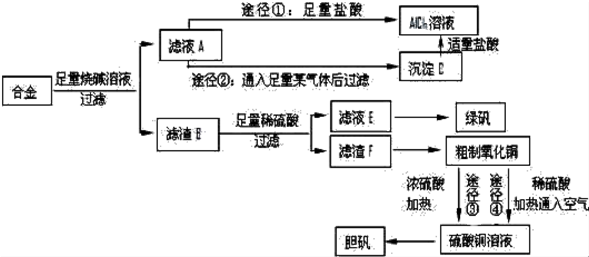
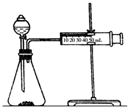 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
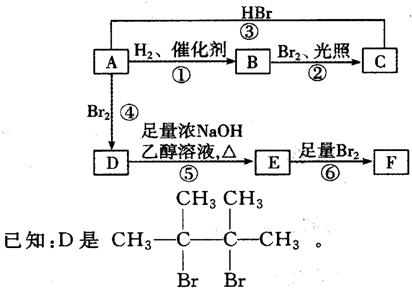
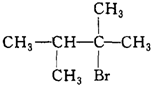 .
. ;;写出由E-F的化学方程式
;;写出由E-F的化学方程式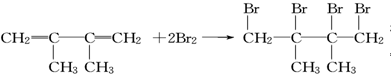 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
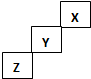
| A. | Z一定是活泼的金属元素 | |
| B. | X的最高价氧化物的水化物是一种强酸 | |
| C. | Y的气态氢化物最稳定 | |
| D. | Z单质可与盐酸反应置换出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R为ⅤA族元素 | |
| B. | R的氢化物的水溶液属于强酸 | |
| C. | 氧化剂与还原剂的物质的量之比为5:1 | |
| D. | R2在常温常压下一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.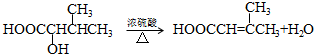 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 比较金属性:Mg>Al | 往盛同浓度同体积的盐酸的两试管中分别加入Mg条和Al粉 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 比较氧化性:Fe3+>I- | 往滴有CCl4的FeI2溶液中慢慢滴加氯水 |
| D | 配制1.0mol/L的NaOH溶液 | 称取4g NaOH晶体溶于100mL蒸馏水中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com