
| A. | 常温常压下,23gNO2含有NA个氧原子 | |
| B. | 常温常压下,18mLH2O约含有NA个H2O分子 | |
| C. | 含14 NA个电子的N2分子的物质的量是1mol | |
| D. | 0.1mol/L的Ba(OH)2溶液中,OH-的个数为0.2NA个 |
分析 A、求出二氧化氮的物质的量,然后根据1mol二氧化氮中含2mol氧原子来分析;
B、常温常压下,水的密度为1g/mL,求出水的质量,然后根据分子个数N=$\frac{m}{M}{N}_{A}$来计算;
C、1mol氮气中含14mol电子;
D、溶液体积不明确.
解答 解:A、23g二氧化氮的物质的量为0.5mol,而1mol二氧化氮中含2mol氧原子,故0.5mol二氧化氮中含NA个氧原子,故A正确;
B、常温常压下,水的密度为1g/mL,故18mL水的质量为18g,而分子个数N=$\frac{m}{M}{N}_{A}$=$\frac{18g}{18g/mol}×{N}_{A}/mol$=NA个,故B正确;
C、1mol氮气中含14mol电子,故含14NA个电子的氮气分子的物质的量为1mol,故C正确;
D、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
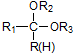 $\stackrel{H+/H_{2}O}{→}$
$\stackrel{H+/H_{2}O}{→}$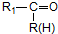
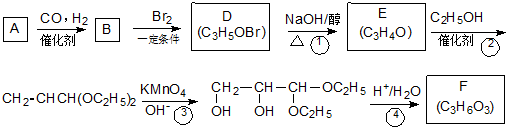
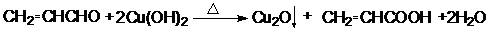 ;
;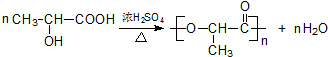 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用精密pH试纸测得某碱溶液的pH为12.3 | |
| B. | 用25mL酸式滴定管量取13.50mLK2Cr2O7溶液 | |
| C. | 测定中和热实验的玻璃仪器只需烧杯、量筒和温度计 | |
| D. | 用带橡皮塞的试剂瓶保存Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、K+、Cl-、AlO2- | |
| B. | 0.1mol•L-1的HNO3溶液中:K+、[Ag(NH3)2]+、Cl- | |
| C. | 含有大量Fe3+的溶液中:Na+、H+、I-、SO42- | |
| D. | 澄清透明的溶液中:Cu2+、SO42-、Mg2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 0.1mol/L的FeCl3溶液 | B. | 20mL 0.1mol/L的MgCl2溶液 | ||
| C. | 30mL 0.2mol/L的KCl溶液 | D. | 100mL 0.25mol/L的HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
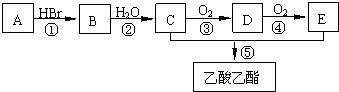
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间 | |
| C. | Na和H2O的反应不是离子反应,因为反应中没有离子参加 | |
| D. | 根据分散系是否具有丁达尔现象,将分散系分为溶液、胶体和浊液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com