
【题目】FeCl3,学名三氯化铁,是黑棕色结晶,主要用于金属蚀刻,污水处理等。解答下列问题。
(1)按照物质的分类方法,FeCl3应属于_________。
①酸 ②氯化物 ③混合物 ④盐 ⑤化合物 ⑥电解质 ⑦易溶物
A.②③④⑤⑥⑦ B.①④⑥⑦ C.②④⑤⑥⑦ D.④⑤⑥⑦
(2)0.1mol/LFeCl3溶液中c(Cl-)=_____mol/L。测得200mL某浓度FeCl3溶液中Cl-的质量为21.3g,则此溶液中c(Fe3+) =____________mol/L.
(3)将50mL 0.1mol/L FeCl3和50mL 0.5mol/L CaCl2混合后,其溶液的体积变为二者的体积之和,则混合液中Cl-的物质的量浓度为_____mol/L.
(4)芳香族化合物A的分子式为C7H8O,A中加入FeCl3溶液显紫色,且苯环上的一氯代物只有二种,A的结构简式为________,写出A与浓溴水反应的方程式________。
(5)FeCl3可制备氢氧化铁胶体处理污水,处理污水时发生了__________(物理或化学)变化。
【答案】C 0.3 1 0.65 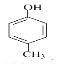
 化学变化
化学变化
【解析】
(1)①氯化铁电离出的阳离子是铁离子,属于盐,不是酸,①错误;
②氯化铁由铁和氯两种元素组成,属于氯化物,②正确;
③氯化铁由一种物质组成,属于纯净物,不是混合物,③错误;
④氯化铁在水溶液中可以电离出铁离子和氯离子,故其属于盐,④正确;
⑤氯化铁由铁和氯两种元素组成,属于化合物,⑤正确;
⑥氯化铁溶于水电离出阴阳离子,属于电解质,⑥正确;
⑦氯化铁易溶于水,属于易溶物,⑦正确。
答案选C。
(2)根据化学式可知0.1mol/LFeCl3溶液中c(Cl-)=0.1mol/L×3=0.3mol/L。测得200mL某浓度FeCl3溶液中Cl-的质量为21.3g,物质的量是21.3g÷35.5g/mol=0.6mol,则此溶液中铁离子的物质的量是0.2mol,其浓度为c(Fe3+)=0.2mol÷0.2L=1.0mol/L;
(3)将50mL0.1mol/LFeCl3和50mL0.5mol/LCaCl2混合后,其溶液的体积变为二者的体积之和,则混合液中Cl-的物质的量浓度为![]() ;
;
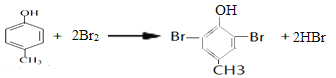
(4)芳香族化合物A的分子式为C7H8O,A中加入FeCl3溶液显紫色,含有酚羟基,且苯环上的一氯代物只有二种,说明含有的取代基即甲基和酚羟基处于对位,则A的结构简式为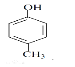 ,A与浓溴水反应的方程式为
,A与浓溴水反应的方程式为 ;
;
(5)FeCl3溶于水电离出的铁离子水解生成氢氧化铁胶体,胶体具有吸附性,因此处理污水时发生了化学变化。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关甲烷的取代反应的叙述正确的是
A. 甲烷与氯气的物质的量之比为1∶1,混合发生取代反应只生成CH3Cl
B. 甲烷与氯气的取代反应,生成的产物中CH3Cl最多
C. 甲烷与氯气的取代反应生成的产物为混合物
D. 1 mol甲烷生成CCl4最多消耗2 mol氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
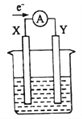
A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C. SO42-移向X电极,Y电极上有氢气产生
D. X极上发生的是还原反应,Y极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在平板电视显示屏生产过程中产生的废玻璃粉末中含有二氧化铈(CeO2)。
(1)在空气中煅烧Ce(OH)CO3可制备CeO2,该反应的化学方程式________;
(2)已知在一定条件下,电解熔融状态的CeO2可制备Ce,写出阳极的电极反应式________;
(3)某课题组用上述废玻璃粉末(含有SiO2、Fe2O3、CeO2以及其它少量不溶于稀酸的物质)为原料,设计如图流程对资源进行回收,得到Ce(OH)4和硫酸铁铵。

①过滤得到滤渣B时,需要将其表面杂质洗涤干净。洗涤沉淀的操作是________。
②反应①的离子方程式为______________________。
③如下图,氧化还原滴定法测定制得的Ce(OH)4产品纯度。
![]()
该产品中Ce(OH)4的质量分数为________________(保留两位有效数字)。若滴定所用FeSO4溶液已在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度__________ (“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铁是聚合反应中常用的一种催化剂,易潮解变质,800℃以上可升华,高温时FeBr3 会快速分解为FeBr2。某校同学设计实验用干燥的HBr 与Fe 反应制备少量FeBr2,实验装置如下(部分夹持装置已省略),请回答相关问题:
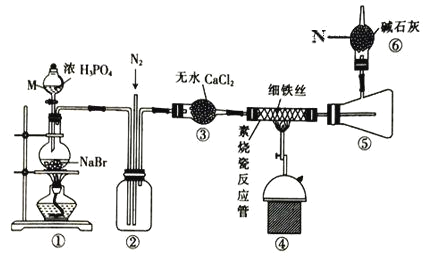
(1)仪器 M 名称是___,装置④中主要的化学方程式为__________。
(2)装置⑥的作用是___,逸出的气体主要是_____(填化学式)。
(3)实验结束时要关闭热源并继续通入N2一段时间,此时通N2的目的是____。
(4)将浓磷酸换成浓硫酸同样能制得 HBr,但反应过程中圆底烧瓶内的溶液变为橙黄色。
①浓磷酸和浓硫酸均能用于制 HBr 的原因是硫酸和磷酸都具有___(填选项字母)。
a.脱水性 b.强氧化性 c.难挥发性
②溶液变橙黄色是因为发生了副反应____(写化学方程式)。
③浓磷酸换成浓硫酸对产品纯度____ (填“有”或“没有”)影响,理由是__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于化合反应的是
A. Zn +2AgNO3== Zn (NO3)2 + 2Ag B. 2FeCl2 + Cl2 == 2FeCl3
C. Cu(OH)2+ 2HCl == CuCl2+ 2 H 2O D. CaCO3![]() CaO+ CO2↑
CaO+ CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com