
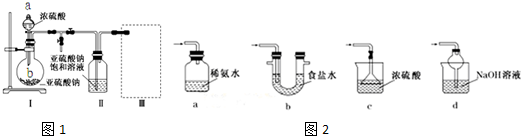
分析 (1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤操作;
(3)装置Ⅲ用于处理尾气,吸收为反应的二氧化硫,应防止倒吸,且不能处于完全密闭环境中;
(4)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,故检验溶液呈酸性即可;
(5)Na2S2O5晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可;
(6)①由消耗碘的量,结合SO2+I2+2H2O═H2SO4+2HI计算二氧化硫的质量,进而计算浓度;
②若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小.
解答 解:(1)该仪器名称是分液漏斗;由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:分液漏斗;Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离,使用的仪器是玻璃棒、漏斗、烧杯;
故答案为:玻璃棒、漏斗、烧杯;
(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d;
(4)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl溶液、品红溶液都不能说明溶液呈酸性,故选ae;
故答案为:ae;
(5)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成;
(6)①令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.025L×0.01mol/L
所以,64g:mg=1mol:0.025L×0.01mol/L,
解得m=0.016
故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为$\frac{0.016g}{0.1L}$=0.16 g/L
故答案为:0.16;
②若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低,
故答案为:偏低.
点评 本题考查物质的制备实验、实验方案设计、物质含量的测定、氧化还原反应滴定等,难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,难点是(6)题计算,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 制取氯乙烷(CH3一CH2Cl)的最好的方法是乙烷与氯气发生取代反应 | |
| B. | 乙烯、苯都能使溴水褪色,两者的褪色原理相同 | |
| C. | 2-丁烯不存在顺反异构体 | |
| D. | 研究有机物一般要经过的基本步骤为:分离、提纯→元素定量分析(确定实验式)→测定相对分子质量(确定分子式)→波谱分析(确定结构式),其中最早提出元素定量分析的是法国化学家李比希 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应既属于氧化还原反应,又属于离子反应 | |
| B. | 生成1 mol Cl2转移电子数均为2NA | |
| C. | 盐酸浓度越大,Cl-的还原性越强 | |
| D. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
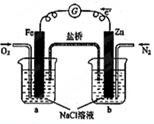
| A. | 向烧杯a中加入少量K3[Fe(CN)6]溶液,没有蓝色沉淀生成 | |
| B. | 烧杯b中发生反应为Zn+2e-=Zn2+ | |
| C. | 电子从Zn极流出,流入Fe极,经盐桥回到Zn极 | |
| D. | 烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.
PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中水电离出的c(H+)=10-10 mol•L-1 | |
| B. | 溶液中c(H+)+c(A-)=0.1 mol•L-1 | |
| C. | 与0.05 mol•L-1 NaOH溶液等体积混合,水的电离平衡向正向移动 | |
| D. | 上述溶液中加入一定量NaA晶体或加水稀释,溶液的c(OH-)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+2HCl═ZnCl2+H2↑ | B. | O2+4HCl═2Cl2+2H2O | ||
| C. | MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O | D. | 2HCl═Cl2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
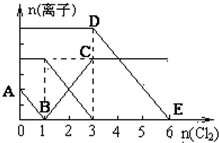 已知:2Fe3++2I-═2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
已知:2Fe3++2I-═2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )| A. | 线段BC代表Fe3+物质的量的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6 mol/L | |
| C. | 原溶液中n (Fe2+):n (I-):n(Br-)=2:1:3 | |
| D. | 当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I━+2Cl2═2Fe3++I2+4Cl━ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com