
�����й�˵����ȷ����
| A��NH4Cl(s)��NH3(g)+HCl(g)�����²����Է����У�˵���÷�Ӧ�Ħ�H��0 |
| B����п����Ʒ�Ʋ����������Ʒ������ǰ���������⣬�����������෴ |
C������N2(g)+3H2(g) 2NH3(g)����������������ʱ��ѹ���������ʹѹǿ��������Ӧ���淴Ӧ�����Լ�H2��ƽ��ת���ʾ����� 2NH3(g)����������������ʱ��ѹ���������ʹѹǿ��������Ӧ���淴Ӧ�����Լ�H2��ƽ��ת���ʾ����� |
| D��100��ʱˮ�����ӻ�����KwΪ5.5��10��13��˵��ˮ�ĵ����Ƿ��ȷ�Ӧ |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����������д�����з�Ӧ���Ȼ�ѧ����ʽ��
��1����NA��ʾ�����ӵ���������C2H2(��̬)��ȫȼ������CO2��Һ̬ˮ�ķ�Ӧ�У�ÿ��4NA������ת��ʱ���ų�450 kJ�����������Ȼ�ѧ����ʽΪ______________________��
��2����֪��1 mol H��H����1 mol N��H����1 mol N��N���ֱ���Ҫ��������436 kJ��395 kJ��940 kJ����N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ____________________________��
��3���ѣ�Ti������Ϊ��������֮��ĵ�����������֪�ɽ��ʯ��TiO2����ȡ����Ti���漰�IJ���Ϊ��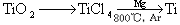
��֪����C(s)+O2(g) 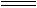 CO2(g); ��H=��395.5 kJ��mol-1
CO2(g); ��H=��395.5 kJ��mol-1
��2CO(g)+O2(g) 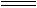 2CO2(g); ��H=��560 kJ��mol-1
2CO2(g); ��H=��560 kJ��mol-1
��TiO2(s)+2Cl2(g)+2C(s) 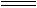 TiCl4(s)+2CO(g)�Ħ�H=�D80kJ/mol
TiCl4(s)+2CO(g)�Ħ�H=�D80kJ/mol
��TiO2(s)��Cl2(g)��Ӧ���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����ȼ�շ�Ӧ�ķ�Ӧ�Ȳ���ȼ���ȵ���
��H2(g)��O2(g)=H2O(l) ��H1 ��C(s)��O2(g)=CO(g) ��H2
��S(s)��O2(g)=SO2(g) ��H3 ��2H2S(g)��3O2(g)=2SO2(s)��2H2O(l) ��H4
| A���٢� | B���ڢ� | C���ڢ� | D���٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��H2(g) �� F2(g) = 2HF(g) ��H��? 270 kJ/mol������˵����ȷ����
| A������ͬ�����£�1 mol H2��1 mol F2�������ܺʹ���2 mol HF��������� |
| B��1 mol H2��1 mol F2��Ӧ����2 molҺ̬HF�ų�������С��270 kJ |
| C���÷�Ӧ���淴Ӧ�Ƿ��ȷ�Ӧ |
| D���÷�Ӧ���̵������仯������ͼ����ʾ |
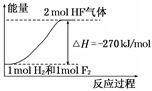
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
2HI(g)  H2(g)+I2(g)��Ӧ�����������仯��ͼ��ʾ(ͼ��E1��ʾ����Ӧ�Ļ�ܣ�E2��ʾ�淴Ӧ�Ļ��)�������й�������ȷ����
H2(g)+I2(g)��Ӧ�����������仯��ͼ��ʾ(ͼ��E1��ʾ����Ӧ�Ļ�ܣ�E2��ʾ�淴Ӧ�Ļ��)�������й�������ȷ����
| A���÷�ӦΪ���ȷ�Ӧ |
| B�������¶ȣ���Ӱ�����Ӱٷ��� |
| C�������ܽ��÷�Ӧ�Ļ�� |
| D���淴Ӧ�Ļ�ܵ�������Ӧ�Ļ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������������ȷ����
| A�������������ڿ�������ѧ��ʴ�����䰵 |
| B������ȼ�ϵ����һ�ֽ���ѧ��ת��Ϊ���ܵ�װ�� |
| C�����ý������Ը��������Һ����ֽ������������������Ư���� |
| D�����ϴ���ȫ��ʧ�衱���г�ʹ�ó�Ϊ���У�����Ϊ���ϴ�����ռ�����أ������Խ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���й�������ת������ʶ�У�����ȷ���ǣ� ��
| A���׳�ƹ���ʱ������ת��Ϊ��ѧ�� |
| B����ɫֲ����й������ʱ��̫����ת��Ϊ��ѧ�� |
| C�����ˮ��������������������ת��Ϊ��ѧ�� |
| D��úȼ��ʱ��ѧ����Ҫת��Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�������������Ȼ�ѧ����ʽ��
H2��g��+ 1/2 O2(g) = H2O(g) �� ��H��a kJ/mol
H2��g��+ 1/2 O2(g) =H2O(l) �� ��H��b kJ/mol
2 H2��g��+ O2(g) ="2" H2O(l) �� ��H��c kJ/mol
���й������ǵı�����ȷ����( )
| A�����Ƕ������ȷ�Ӧ | B��a��b��c��Ϊ��ֵ |
| C����Ӧ�ȵĹ�ϵ��a=b | D����Ӧ�ȵĹ�ϵ��2b=c |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(6��)��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش� �������⣺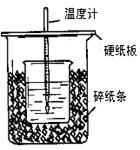
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ�� ��
��2���ձ���������ֽ���������� ��
��3�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ (�ƫ��ƫС��
��Ӱ�족)
��4�������60mL0.50mol/L������50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������� (���ȡ�����ȡ�)�������к���_______ (���ȡ�����ȡ�)��
��5������ͬŨ�Ⱥ�����İ�ˮ(NH3��H2O)����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ�� �����ƫ����ƫС��������Ӱ�족����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com