

| 1.8mol |
| 3mol |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| O | 2- 4 |
| O | 2- 3 |
| O | 2- 4 |
| O | 2- 4 |
| O | 2- 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
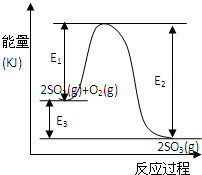
 ���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮T��ʱ��Ӧ2SO2��g��+O2��g��?2SO3��g�������е������仯��ͼ��ʾ���ش��������⣮
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮T��ʱ��Ӧ2SO2��g��+O2��g��?2SO3��g�������е������仯��ͼ��ʾ���ش��������⣮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����


| ||
| �� |
| ||
| �� |
| T/K | 303 | 313 | 323 |
| CA2������/��10-1mol�� | 4.3 | 5.9 | 6.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
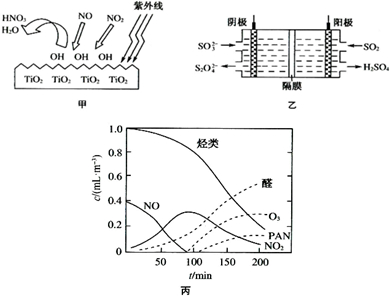
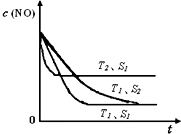 ���������Ǵ�����Ⱦ��֮һ��������������ķ����ж��֣�
���������Ǵ�����Ⱦ��֮һ��������������ķ����ж��֣�| 180�� |
| ���� |
| ClO2 |
| ��Ӧ�� |
| Na2SO3 |
| ��Ӧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1����֪1.0mol��L��1NaHSO3��Һ��pHΪ3.5�������Һ����Ũ�ȴӴ�С��˳��Ϊ �������ӷ��ű�ʾ����
 ��2����֤��Na2SO3��Һ�д���ˮ��ƽ��SO32��+H2O
��2����֤��Na2SO3��Һ�д���ˮ��ƽ��SO32��+H2O![]() HSO3��+OH������ʵ�� ������ţ���
HSO3��+OH������ʵ�� ������ţ���
A�������̪��Һ��죬�ټ���H2SO4��Һ��ɫ��ȥ
B�������̪��Һ��죬�ټ�����ˮ���ɫ��ȥ
C�������̪��Һ��죬�ڼ���BaCl2��Һ����������Һ�ɫ��ȥ
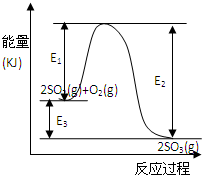
��3����ҵ�����ô�������Ӧ��SO2ת��ΪSO3��2SO2+ O2 ![]() 2SO3����ij�¶��£��˷�Ӧ����ʼŨ��c��SO2��=1.0mol��L��1��c��O2��=1.5mol��L��1���ﵽƽ���SO2��ת����Ϊ50%������¶��¸÷�Ӧ��ƽ�ⳣ��K�� ��
2SO3����ij�¶��£��˷�Ӧ����ʼŨ��c��SO2��=1.0mol��L��1��c��O2��=1.5mol��L��1���ﵽƽ���SO2��ת����Ϊ50%������¶��¸÷�Ӧ��ƽ�ⳣ��K�� ��
��4����������Һ�У������(KIO3)���������ƿɷ������·�Ӧ��
2IO3����5SO32����2H��===I2��5SO42����H2O
���ɵĵ�����õ�����Һ���飬���ݷ�Ӧ��Һ������ɫ�����ʱ���������÷�Ӧ�����ʡ�ijͬѧ���ʵ�����±���ʾ��
| 0.01mol��L��1 KIO3 ������Һ(������)�����/mL | 0.01mol��L��1 Na2SO3 ��Һ�����/mL | H2O����� /mL | ʵ�� �¶� /�� | ��Һ������ɫʱ����ʱ��/s | |
| ʵ��1 | 5 | V1 | 35 | 25 | |
| ʵ��2 | 5 | 5 | 40 | 25 | |
| ʵ��3 | 5 | 5 | V2 | 0 |
����V2=___________mL����ʵ���Ŀ����______________ ______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com