
| A、明矾能起催化剂作用 |
| B、明矾更易使碳酸氢钠发生分解反应 |
| C、明矾受热分解放出气体 |
| D、明矾在水中能起到酸的作用 |
科目:高中化学 来源: 题型:
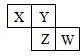 X、Y、Z、W均为短周期元素,它们在周期表的位置如图所示,若W原子的最外层电子数比次外层电子数少1,下列说法中不正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表的位置如图所示,若W原子的最外层电子数比次外层电子数少1,下列说法中不正确的是( )| A、排放X与Y、Z与Y形成的化合物会对环境造成污染 |
| B、Z元素的氢化物沸点比Y元素的氢化物低 |
| C、X的氢化物与W的氢化物相遇会产生白烟 |
| D、W的氢化物会被还原,但不会被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠呈银白色、质软、熔点相对较低、密度比水小 |
| B、铝及其化合物既能与强酸溶液反应又能与强碱溶液反应 |
| C、二氧化硅是一种熔沸点很高、硬度很大的氧化物 |
| D、铁可以与碳或其它多种金属熔合成合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;2Na+2H2O═2NaOH+H2↑ | ||||
B、氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2
| ||||
| C、FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色;2Fe(OH)2+O2+H2O═2Fe(OH)3 | ||||
| D、向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有透明的硅酸凝胶产生;Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 |
| B、加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+2c(SO32-) |
| C、加入一定量的蒸馏水,溶液中c(H+) 和c(OH-)都减少 |
| D、加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、标况下1L辛烷完全燃烧后恢复至原状态,生成气态物质分子数为
| ||
| B、28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | ||
| C、0.5mol丙烷含有5NA个共价键 | ||
| D、1mol乙烷含18NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 0 | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:
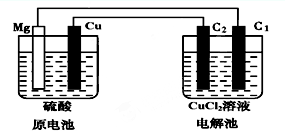 某研究性学习小组的课题为“Mg-Cu硫酸原电池电解CuCl2溶液的研究”,他们的研究装置如图所示(C1、C2均为碳棒),按要求填写下列空格.
某研究性学习小组的课题为“Mg-Cu硫酸原电池电解CuCl2溶液的研究”,他们的研究装置如图所示(C1、C2均为碳棒),按要求填写下列空格.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com