
| A、溶液中水电离出的H+个数:②>① |
| B、溶液中阴离子的物质的量浓度之和:①>② |
| C、①溶液中:n(OH-)=n(HCO3-)+2n(H2CO3)+n(H+) |
| D、②溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |


科目:高中化学 来源: 题型:
| A、CsOH是一种强碱,比KOH的碱性强 |
| B、铯与水或酸溶液反应剧烈,都生成H2 |
| C、Cs的还原性比Na的强,故Na+的氧化性强于Cs+ |
| D、Na的金属性强于Cs的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数:X>Z>Y |
| B、原子半径:Y>Z>X |
| C、离子半径:Z2->X+>Y+ |
| D、一定能形成化合物X2Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2和H2一定条件下反应制取NH3 |
| B、硝酸工厂用NH3氧化制取NO |
| C、铜与浓硝酸反应产生NO2 |
| D、由NH3制碳酸氢铵和硫酸氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
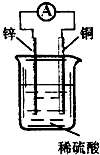
| A、铜片上发生氧化反应 |
| B、电子由锌片通过导线流向铜片 |
| C、该装置能将化学能转化为电能 |
| D、锌片是该装置的负极,该电极反应为Zn-2e-═Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com