
��16�֣������������ҹ�����Դ������ռ�ϴ���أ������ŷų���SO2�����һϵ�л�������̬���⣬ֱ���ŷź�SO2���������γ����꣬Σ��������
��1���û�ѧ����ʽ��ʾSO2�γ�����������ķ�Ӧ�� ��
��2����ҵ����Na2SO3��Һ���������е�SO2��������ͨ��1.0 mol��L-1��Na2SO3��Һ����ҺpH���ϼ�С������ҺpHԼΪ6ʱ������SO2�����������½���Ӧ�������ռ���
�� ��ʱ��Һ��c(SO32�C)��Ũ����0.2 mol��L-1������Һ��c(HSO3�C)��_______mol?L-1��
�� ��pHԼΪ6�����ռ���ͨ��������O2���ɽ����е�NaHSO3ת��Ϊ�������ʣ���Ӧ�Ļ�ѧ����ʽ�� ��
�� ij�о�С��Ϊ̽����ߺ���������SO2��
����Ч�ʵĴ�ʩ��ģ��ʵ�����պ���������ʵ������ͼ��ʾ���� ��
���������SO2������Ч�ʡ�

��3�������ֿ��ŵ�Na2SO3ҩƷ�Ѳ��ֱ�����
�������û�ѧС��������֪Ũ�ȵ�����KMnO4
��Һ��ȷ���京�������岽�����£�
����i����ȡ��Ʒ1.000 g��
����ii������Ʒ�ܽ����ȫת�Ƶ�250 mL����ƿ�У����ݣ����ҡ�ȡ�
����iii����ȡ25.00 mL��Ʒ��Һ��250 mL��ƿ�У���0.01000 mol��L��1 KMnO4����Һ�ζ����յ㡣
�����������������ظ�2�Ρ�
�� д������iii��������Ӧ�����ӷ���ʽ___________________________________��
�� ������0.01000 mol��L��1 KMnO4��Һʱ�����Ӷ��ݣ������ղ��ҩƷ��Na2SO3�ĺ���________(�ƫ����ƫС������Ӱ�족)��
�� ijͬѧ����������������еζ�ʵ��(�гֲ�����ȥ)��������������_ (����ĸ)��





A B C D E
�� �ζ�������±���ʾ��
�ζ����� | ������Һ �����/mL | ����Һ����� | |
�ζ�ǰ�̶�/mL | �ζ���̶�/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 2.20 | 20.20 |
���ҩƷ��Na2SO3����������Ϊ_________��
��16�֣�
��1��SO2��H2O H2SO3��2H2SO3��O2��2H2SO4 ��2�֣�
H2SO3��2H2SO3��O2��2H2SO4 ��2�֣�
����2SO2��O2  2SO3��SO3��H2O��H2SO4 ��2SO2��O2��2H2O��2H2SO4��
2SO3��SO3��H2O��H2SO4 ��2SO2��O2��2H2O��2H2SO4��
��2���� 1.6 ��2�֣�
�� 2NaHSO3��O2��Na2SO4��H2SO4 ��2�֣�
�� ���ͺ����������¶ȣ����С�������������٣� ��2�֣�
��3���� 2MnO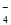 ��5SO
��5SO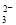 ��6H����2Mn2����5SO
��6H����2Mn2����5SO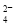 ��3H2O�� ��2�֣�
��3H2O�� ��2�֣�
�� ƫ�� ��2�֣� �� AC ��2�֣�©ѡ��1�֣���ѡ0�֣�
�� 63.00% ��63.0% ��2�֣�д��63%����1�֣�
��������
�����������1��������������ˮ���������ᣬ������������е�������Ӧ�������ᣬ�ù��̵Ļ�ѧ����ʽΪSO2��H2O H2SO3��2H2SO3��O2��2H2SO4
H2SO3��2H2SO3��O2��2H2SO4
��2���ٸ��ݵ���غ㣬�ɵ�c(H��)+ c(Na+)= c(OH��)+2 c(SO32�C)+c(HSO3�C)������c(HSO3�C)= c(H��)+ c(Na+)- c(OH��)-2 c(SO32�C)=��1.0+10-6-10-8-2��0.2��mol��L-1������c(HSO3�C)����Ϊ1.6mol/L��
���ɢٿ�֪NaHSO3����Һ�����ԣ���������Ӧ�����ɵ�2������Ӧ�������������ᣬ��ѧ����ʽΪ2NaHSO3��O2��Na2SO4��H2SO4 ��
����ͼ��֪��������������������¶����߶����ͣ������ߵĶ����������������ߣ�������������С���������SO2������Ч�ʿ��Խ��ͺ����������¶ȣ����С�������������٣���
��3���ٸ��������Һ���������Ʒ���������ԭ��Ӧ���������ơ������̡�ˮ�����Բ���iii��������Ӧ�����ӷ���ʽ2MnO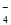 ��5SO
��5SO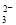 ��6H����2Mn2����5SO
��6H����2Mn2����5SO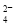 ��3H2O��
��3H2O��
�����Ƹ��������Һʱ���Ӷ��ݣ���������Һ��Ũ��ƫ�ͣ��ζ�ʱ���ĸ��������Һ�������ƫ��������ղ��ҩƷ��Na2SO3�ĺ���ƫ��
�۸���ʵ�鲽���֪����Ʒ��Һ������ƿ�У��ζ���Һ���ڵζ����ڣ�������ؾ���ǿ�����ԣ�����Ӧʹ����ʽ�ζ��ܣ����������������AC��
���ɱ������ݿ�֪3��ʹ�ø��������Һ������ֱ���20.01mL��19.99mL��18.00mL��������������ǰ������ϴ���ȥ����ǰ�����ƽ��ֵ���㣬ƽ��ֵ��20.00mL������2MnO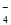 ��5SO
��5SO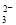 ������Ʒ���������Ƶ�����Ϊ0.02L��0.01000 mol��L��1��2.5��10��126g/mol=0.63g��������Ʒ���������Ƶ�����������0.63g/1.0000g��100%=63.00%��
������Ʒ���������Ƶ�����Ϊ0.02L��0.01000 mol��L��1��2.5��10��126g/mol=0.63g��������Ʒ���������Ƶ�����������0.63g/1.0000g��100%=63.00%��
���㣺���黯ѧ����ʽ����д����Һ����Ե��жϣ�����Ũ�ȵļ��㣬�ζ��������жϼ�����


 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д� ѧҵ����һ��һ��ϵ�д�
ѧҵ����һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ�����л�ѧ�����ޣ��Ծ��������棩 ���ͣ�ѡ����
����ʳƷ���Ӽ�����˵���������
A��ʳ�ס�����ζ�� B���������ơ�����ζ��
C��̼�����ơ������ɼ� D�������ᡪ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡ�����еڶ�ѧ�ڸ߶���ĩͳ�⻯ѧ�Ծ��������棩 ���ͣ������
��ϩ�����ںϳ���ɱ�������߳��ũҩB������ʽΪC3H5Br2Cl�����÷�����ÿ��̼ԭ���Ͼ�����±ԭ�ӣ���ϳ�·������ͼ��ʾ��

��1����ϩ�Ľṹ��ʽ��  �������еĹ����������� ��
�������еĹ����������� ��
��2�� ��A����B�ķ�Ӧ������ ��
��A����B�ķ�Ӧ������ ��
 ��3��Aˮ��ɵõ� CH2=CHCH2OH����ˮ�ⷴӦ�Ļ�ѧ����ʽΪ�� ��
��3��Aˮ��ɵõ� CH2=CHCH2OH����ˮ�ⷴӦ�Ļ�ѧ����ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡ�麣�и���ѧҵ��������ģ���ۻ�ѧ�Ծ��������棩 ���ͣ������
��16�֣�
��1����ͼΪʵ�����Ʊ����ռ�����HCl��װ�á�

�� �Ʊ�HCl����ҩƷΪŨ�����Ũ���ᣬ������װ��Ӧѡ����ͼ�е� ��

�� ���������Ũ�����Ũ�����Ʊ�HCl�����ԭ�� ��
�� װ�ñ��������չ�����HCl���壬Ϊ��ֹ���������ձ���Ӧ��װ��ˮ�� ��
��2������Ϊ����ȡ����Ӧ��̽��ʵ�顣

�� ����ͼ��ʾ��װ��ͼ���Ӻø�������
�� ����װ�õ������ԡ�
�� ��A�м��������ı���Һ��Ļ��Һ�壬��B�м����������ۣ�������Ƥ������K1����ʼ���з�Ӧ�������������Һ�ر�K1��
д��B�з�����Ӧ�Ļ�ѧ����ʽ ��
װ��C�������� ��
�� ��Ӧ���������Թ�ȡ����D�е���Һ������
�������Լ���������֤��B�е�ȡ����Ӧ�Ѿ�������
�� ��B�еĹ�Һ���������ˣ������Һ���������ͼ�������ƺ��б�������屽��
�����Լ�Ϊ ����������Ϊ ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡ�麣�и���ѧҵ��������ģ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������������ȷ����
A���������Ⱦ��л�ԭ�ԣ�����������ˮ��ɱ������
B��̼������Һ�ʼ��ԣ�ҽ���ϳ���̼��������θ�����
C����ˮ�м���������¶���ʹˮ�����ӻ���С������ƽ�������ƶ�
D����¯�г�����CaSO4����Na2CO3��Һ���ݺ��ٽ���������ϡ�����ܽ�ȥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡ������һ����У�����5����ģ��ѧ�Ծ��������棩 ���ͣ�ѡ����
W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯��ͼ����֪W��һ�ֺ��ص�������Ϊ18��������Ϊ10��X��Neԭ�ӵĺ�����������1��Y��������ۺ������֮��Ϊ0��Z�ķǽ�������ͬ����Ԫ������ǿ������˵����ȷ����
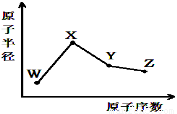
A����Ӧ��̬�⻯����ȶ��ԣ�Y��Z
B��������XZW�Ⱥ����Ӽ�Ҳ�����ۼ�
C����Ӧ�����Ӱ뾶��W��X
D��Y������������Z��X������������Ӧ��ˮ���ﷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
H2O2��CH3COOH�������г��������ʣ��ڻ�ѧ�о���Ӧ�ù㷺��
��1��ijС������Fe3+�Ĵ��£�̽��H2O2�ֽ�����Ӱ���ijһ���ء���ѡ�Լ���������30% H2O2��0.1mol?L-1Fe2(SO4)3������ˮ����ƿ��˫������ˮ�ۡ����ܡ��������ܡ���Ͳ�����������ˮԡ�ۡ�ע����
�����������Ļ����Һ�ֱ���뵽2��ͬ�ݻ�����ƿ�У��ռ����������壬��¼�����ͬ�������������ʱ�䡣
��ƿ��� | 30% H2O2/mL | 0.1mol?L-1Fe2(SO4)3/mL | ����ˮ/mL | ��Ӧ�¶�/�� |
1 | 10 | 1 | 0 | 30 |
2 | Vx | 1 | 5 | 30 |
����Vx= mL��ʵ��Ŀ���� ��
��2������������ǻ�ѧʵ���г����Ķ���һԪ�ᣬijС���������ʵ��֤�����ǵĵ���̶ȡ�
ʵ��һ�������£����0.1mol?L-1���������pHֵ�ֱ�Ϊ3��1����ʾ��pH=-lgc(H+)
����һ��������ˮ��Һ�е��� �����ȫ���� ������ȫ���������¶��´���ĵ����Ϊ ��д������ĵ��뷽��ʽ
ʵ�������ȡ�������Ũ�Ⱦ�Ϊ1mol?L-1���������ֱ���뾭ɰֽ��ĥ���ı������ͬ��þ�����۲�ų��������ʵĿ�����
���۶�������������ͬʱ��ͬŨ��ͬ�����һԪ���������Ӧʱ����Ӧ ����족����������Ϊ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡտ���и����꼶�ڶ���ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��16�֣���ҵ�Ͽ������̿���Ҫ�ɷ���MnO2���ͻ�������Ҫ�ɷ���FeS2��Ϊ��Ҫԭ���Ʊ������ܴ��Բ���̼���̣�MnCO3�����乤ҵ�������£�
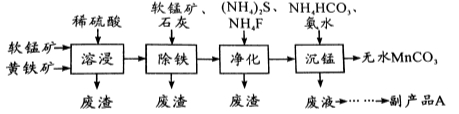
�ش��������⣺
��1��Ϊ������ܽ�������ԭ�ϵĽ����ʣ����Բ�ȡ�Ĵ�ʩ�У�дһ���� ��
��2�����������У��ڼ���ʯ�ҵ�����Һ��pHǰ���������������̿��������ǣ�
��
��3�����������Ŀ���dz�ȥ��Һ�е�Cu2+��Ca2+�����ʡ��������Һ��c(F-)=0.01 mol?L-1����Һ�в�����c(Ca2+)= ����֪��Ksp(CaF2)=1.46��10-10����
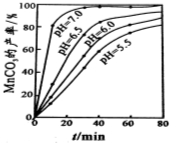
��4�����̹����У�298K��c(Mn2+)Ϊ1.05 mol?L-1ʱ��ʵ����MnCO3�IJ�������ҺpH����Ӧʱ��Ĺ�ϵ��ͼ��ʾ������ͼ����Ϣ�ó��Ľ����� ��
��5�����̹�������CO2���ɣ�������MnCO3�����ӷ���ʽ�� ��
��6���ӳ��̹����еõ�����MnCO3�IJ��������� ��
����ƷA�Ļ�ѧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡ��һѧ�����տ��Ը�һ����ѧ���Ծ��ң������棩 ���ͣ�ѡ����
��KCl��KBr�����13��4g����ˮ���500mL��Һ��ͨ�����Cl2����Ӧ����Һ���ɵù���11.175g����ԭ������Һ��K����Cl����Br�������ʵ���Ũ��֮��Ϊ��
A��3:2:1 B��1:2:3 C��1:3:2 D��3:1:1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com