
【题目】某实验需要100mL、0.1mol/L的Na2CO3溶液,
(1)现通过如下操作配制:
①把称量好的固体Na2CO3放入小烧杯中,加适量蒸馏水溶解.为加快溶解可以使用(填仪器名称)搅拌;②把①所得溶液冷却到室温后,小心转入(填仪器名称);③继续加蒸馏水至液面距刻度线1~2cm处,改用(填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切;④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀.
(2)操作步骤正确的顺序是(填序号).
(3)若没有操作④,则所配溶液的浓度会(填“偏高”或“偏低”).
(4)若取出20mL配好的Na2CO3溶液,加蒸馏水稀释成c(Na+)=0.01mol/L的溶液,则稀释后溶液的体积为mL.
(5)在配制100mL 0.1mol/L的Na2CO3溶液时,下列操作中的会导致结果偏低(请用序号填写).
①用托盘天平称量时砝码放在左盘 ②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外 ③定容时俯视刻度线 ④定容时仰视刻度线 ⑤干净的容量瓶未经干燥就用于配制溶液.
【答案】
(1)玻璃棒;100 mL容量瓶;胶头滴管
(2)①②④③⑤
(3)偏低
(4)400
(5)①②④
【解析】解:(1)溶解时,为加快碳酸钠溶解的速度,可用玻璃棒搅拌;配制溶液是在100mL容量瓶中进行,所以应将溶解冷却后的溶液转移到100mL容量瓶中;定容时,加水到离刻度线1﹣2cm时,改用胶头滴管逐滴滴加,防止加水过量;(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、洗涤、定容、摇匀、装瓶,所以正确的顺序为:①②④③⑤;所以答案是:①玻璃棒;②100 mL容量瓶;③胶头滴管;①②④③⑤;(3)若没有操作④,导致部分溶质没有转移的容量瓶,溶质的物质的量偏小,依据C= ![]() ,溶液浓度偏低;所以答案是:偏低;(4)配制好的是0.1mol/L的Na2CO3溶液,其中钠离子浓度为0.2mol/L,设稀释后的溶液的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀来计算可知:0.2mol/L×20mL=0.01mol/L×VmL
,溶液浓度偏低;所以答案是:偏低;(4)配制好的是0.1mol/L的Na2CO3溶液,其中钠离子浓度为0.2mol/L,设稀释后的溶液的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀来计算可知:0.2mol/L×20mL=0.01mol/L×VmL
解得V=400,
所以答案是:400;(5)①配制100mL、0.1mol/L的Na2CO3溶液,需要碳酸钠的质量m=0.1mol/L×0.1L×106g/mol=1.1g,依据左盘质量等于右盘质量加游码质量,则药品的质量为1g﹣0.1g=0.9g,所以用托盘天平称量时砝码放在左盘,导致秤取的碳酸钠的质量偏小,溶质的物质的量偏小,溶液浓度偏低,故选;
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,导致溶质的物质的量偏小,溶液浓度偏低,故选;
③定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故不选;
④定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故选;
⑤干净的容量瓶未经干燥就用于配制溶液,对溶质的物质的量和溶液的体积都不会产生影响,溶液浓度不受影响,故不选;
故选:①②④.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为3L的密闭容器中,A、B、C三种气态物质的物质的量随时间变化曲线如图所示。请回答以下问题:
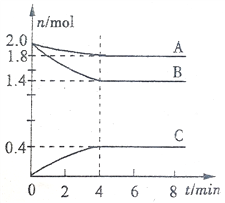
(1)该反应的化学方程式是_________________________________。
(2)反应从开始到平衡时,气体B的平均反应速率是___________________。
(3)该反应的化学平衡常数表达式是______________________________。
(4)其他条件不变,升高温度,逆反应速率将____________(填“加快”、“减慢”或“不变”)。
(5)反应达平衡后,其他条件不变,增加容器体积,平衡将__________(填“正向移动”、“逆向移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 在潮湿的空气中,马口铁和白铁皮镀层受损后,铁都比受损前更容易生锈
B. CaCO3(s) = CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的ΔH<0
C. 反应N2(g)+3H2(g)![]() 2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大
2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大
D. 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值均大于零):H2(g) +Cl2(g) = 2HCl(g) △H1= -Q1 kJ·mol-1 H2(g) +Br2(g) = 2HBr(g) △H2= -Q2 kJ·mol-1 则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<O,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) △H<O,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是

A. 图I研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图II研究的是t0时刻增大压强后对反应速率的影响
C. 图III研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影晌.且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物分子中,在核磁共振氢谱图中能给出三种信号的是( )
A.CH3CH2CH3B.CH3CH2OCH2CH3
C.CH3CH2OHD.CH3OCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B. 对2H2O2![]() 2H2O+O2的反应,使用MnO2可加快制O2的反应速率
2H2O+O2的反应,使用MnO2可加快制O2的反应速率
C. 反应CO+NO2![]() CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
D. 合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,应采取低温高压的措施
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com