
 A��B��C��D����ѧ��ѧ�������������ʣ�����֮����ת����ϵ���£����ַ�Ӧ������������ȥ����
A��B��C��D����ѧ��ѧ�������������ʣ�����֮����ת����ϵ���£����ַ�Ӧ������������ȥ�������� ��1����A�ڳ�����Ϊ���壬������������Ӧ����AΪS����BΪSO2��CΪSO3��DΪH2SO4��
��2��A��һ�ֻ��ý�����C�ǵ���ɫ���壬��AΪNa��BΪNa2O��CΪNa2O2��
��3��C�Ǻ���ɫ���壬A��һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬��AΪNH3 ��BΪNO��CΪNO2��DΪHNO3��
��� �⣺��1����A�ڳ�����Ϊ���壬������������Ӧ����AΪS����BΪSO2��CΪSO3��DΪH2SO4���ڹ�ҵ�����У�B����Ĵ����ŷű���ˮ���պ��γ����������Ⱦ�˻�����
�ʴ�Ϊ��H2SO4�����ꣻ
��2��A��һ�ֻ��ý�����C�ǵ���ɫ���壬��AΪNa��BΪNa2O��CΪNa2O2��C������Ϊ�������ƣ��������ƺ�ˮ��Ӧ��2Na2O2+2H2O�T4NaOH+O2������NaOH�Ͷ�����̼��Ӧ����̼���ƣ��������ƺͶ�����̼��Ӧ��2Na2O2+2CO2�T2Na2CO3+O2��������������DΪNa2CO3��
����ʱ������ٵ������Ƕ�����̼��ˮ����̼���Ƶ�������x����̼�����Ƶ������ǣ�10-x��g����
2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+CO2��+H2O �����������
168g 62g
��10-x��g ��10-9.38��g
168g��62g=��10-x��g����10-9.38��g
���x=8.32g��
��̼���Ƶ���������=$\frac{8.32g}{10g}$=83.2%��
�ʴ�Ϊ���������ƣ�2Na2O2+2H2O�T4NaOH+O2����Na2CO3��83.2%��
��3��C�Ǻ���ɫ���壬A��һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬��AΪNH3 ��BΪNO��CΪNO2��DΪHNO3��
��ʵ�������������ƺ��Ȼ���ڼ��������·�Ӧ����������Ӧ�ķ���ʽΪCa��OH��2+2NH4Cl$\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O��
�ʴ�Ϊ��Ca��OH��2+2NH4Cl$\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O��
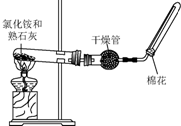
��Ϊ�˼��鰱���Ƿ������ɽ����ɽ�ʪ��ĺ�ɫʯ����ֽ�����Թܿڴ�������ֽ��������֤���������ռ��������ð�ɫ�ķ�̪��ֽ�����Թܿڴ�������ֽ��죬��֤���������ռ�����Ҳ������պ��Ũ����IJ����������Թܿڴ����������������̣���֤���������ռ�����
D��Ũ��Һ�ڳ����¿���ͭ��Ӧ������C���壬�÷�Ӧ�Ļ�ѧ����ʽ��Cu+4HNO3=Cu��NO3��2+2NO2��+2H2O��
�ʴ�Ϊ����ʪ��ĺ�ɫʯ����ֽ�����Թܿڴ�������ֽ��������֤���������ռ�����
�����ð�ɫ�ķ�̪��ֽ�����Թܿڴ�������ֽ��죬��֤���������ռ�����
������պ��Ũ����IJ����������Թܿڴ����������������̣���֤���������ռ������� Cu+4HNO3=Cu��NO3��2+2NO2��+2H2O��
���� ���⿼�������ƶϣ����ڻ���������Ŀ��飬�����������У����ض�ѧ������֪ʶ�Ĺ���ѵ���������������ɫ���ƶϵ�ͻ�ƿڣ�ע��������ѧ����������Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������ԭ�ζ�ʵ��������к͵ζ����ƣ�����֪Ũ�ȵ���������Һ�ζ�δ֪Ũ�ȵĻ�ԭ����Һ��֮��������0.1000mol•L-1KMnO4������Һ�ζ�δ֪Ũ�ȵ���ɫH2C2O4��Һ����Ӧ���ӷ���ʽ�ǣ�2MnO${\;}_{4}^{-}$+5H2C2O4+6H+�T2Mn2++CO2��+8H2O��
������ԭ�ζ�ʵ��������к͵ζ����ƣ�����֪Ũ�ȵ���������Һ�ζ�δ֪Ũ�ȵĻ�ԭ����Һ��֮��������0.1000mol•L-1KMnO4������Һ�ζ�δ֪Ũ�ȵ���ɫH2C2O4��Һ����Ӧ���ӷ���ʽ�ǣ�2MnO${\;}_{4}^{-}$+5H2C2O4+6H+�T2Mn2++CO2��+8H2O��| �ζ����� | ����H2C2O4��Һ�����/mL | 0.1000 mol•L-1 KMnO4�����/mL | ||
| �ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
| ��һ�� | 25.00 | 0.00 | 26.11 | 26.11 |
| �ڶ��� | 25.00 | 1.56 | 30.30 | 2 8.74 |
| ������ | 25.00 | 0.22 | 26.31 | 26.09 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | ��ʼ���� | ������ȫ |
| Fe��OH��2 | 7.6 | 9.6 |
| Fe��OH��3 | 2.7 | 3.7 |
| Cu��OH��2 | 4.0 | 6.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2O��g��=H2O��l����H=-44kJ/mol�����Ըù����Ƿ��ȷ�Ӧ | |
| B�� | �������õ���Դ����ͨ����ѧ��Ӧ��õ� | |
| C�� | 2CO��g��+O2$\frac{\underline{\;��ȼ\;}}{\;}$2CO2��g����H��0����56gCO��32gO2�����е����������88g�����е������� | |
| D�� | ��Ҫ���ȵķ�Ӧһ�������ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 100g��ˮ�к�10gNH3•H2O | B�� | 10gNH3����ˮ�γ�100g��Һ | ||
| C�� | 100g��ˮ�к�10gNH3 | D�� | 10gNH3����100gH2O�γɵ���Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�� | B�� | ���� | C�� | ���� | D�� | Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2ͨ�뵽BaCl2��Һ�У�Ba2++SO2+H2O=BaSO3��+2H+ | |
| B�� | ŨH2SO4����������ȡH2S���壺H2SO4+FeS=Fe2++SO42-+H2S�� | |
| C�� | SO2ʹ��ˮ��ɫ��SO2+2H2O+Br2=4H++SO42-+2Br- | |
| D�� | �Ȼ�粒�������ʯ�ҹ��ȣ�NH4++OH-$\frac{\underline{\;\;��\;\;}}{\;}$NH3��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ԫ�����ڱ���ʾ�˻�ѧԪ�ؼ��������ϵ���ǻ�ѧ��չʷ����Ҫ��̱� | |
| B�� | �����ڱ��У��ѵ��Ӳ�����ͬ��Ԫ���ų�һ���У���Ϊһ���� | |
| C�� | Ԫ�����ڱ��У��ܹ���18�����У�18���壬IIIB�庬��32�ֽ���Ԫ�� | |
| D�� | ��IA�壨��H��Ԫ���ֳ�Ϊ�����Ԫ�أ��ڢ�A��Ԫ���ֳ�Ϊ±��Ԫ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com