
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
由表中数据可知,随温度增大平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应;
(2)提高CO的平衡转化率,应使平衡向正反应移动,但不能增大CO的用量,结合选项根据平衡移动原理分析;
(3)令平衡时CO的物质的量变化为nmol,则:
Fe2O3(s)+3CO(g)?Fe(s)+3CO2(g)
开始(mol):1 1
变化(mol):n n
平衡(mol):1-n n+1
所以$\frac{(n+1)^{3}}{(1-n)^{3}}$=64,解得n=0.6,
再根据v=$\frac{△c}{△t}$计算v(CO),转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;
(4)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行,进而判断v正、v逆的相对大小.
解答 解:(1)Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)的化学平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$;
由表中数据可知,随温度增大平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应,故△H<0,
故答案为:$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$;<;
(2)A.升高温度,平衡常数减少,说明平衡逆向移动,CO的平衡转化率减小,故A错误;
B.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故B正确;
C.加入催化剂,平衡不移动,故C错误;
D.减小体积,平衡不移动,故D错误.
故答案为:B;
(3)令平衡时CO的物质的量变化为nmol,则:
Fe2O3(s)+3CO(g)?Fe(s)+3CO2(g)
开始(mol):1 1
变化(mol):n n
平衡(mol):1-n n+1
所以K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$=$\frac{(n+1)^{3}}{(1-n)^{3}}$=64,解得n=0.6,
v(CO2)=$\frac{\frac{0.6mol}{10L}}{10min}$=0.006 mol•L-1•min-1,
则CO的平衡转化率为$\frac{0.6mol}{1mol}$×100%=60%,
故答案为:0.006 mol•L-1•min-1;60%;
(4)浓度商Qc=$\frac{(1.6+0.5)^{3}}{(0.4+0.5)^{3}}$=12.7<K=64,反应向正反应进行,则v正>v逆,
故答案为:>;正向.
点评 本题考查化学平衡的有关计算、化学反应速率计算、平衡常数等,为高考常见题型,侧重于学生的分析能力和计算能力的考查,化学平衡移动原理分析判断是关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-)
c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
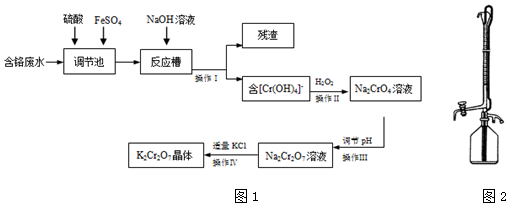
| 实验步骤 | 预期实验结果和结论 |
| ①取一定体积废水样品,分成体积相同两份,其中一份持续通入一段时间N2,以减少水中的溶解氧; | 若溶解氧不同的两份溶液中,测出的砷的浓度不同,则溶解氧对砷的去除效率有影响;反之则无影响. |
| ②向上述两份溶液中投入足量等质量的同种单质铁 | |
| ③相同一段时间后,用分光光度计测定两份水样中砷的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

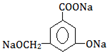 .
.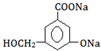 .
.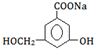 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
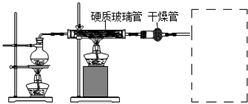
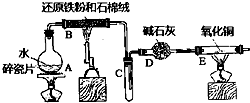 某校化学小组学生利用如图所列装置进行“铁与水反应”的实验,并进行了其他有关实验.(图中夹持及尾气处理装置均已略去)
某校化学小组学生利用如图所列装置进行“铁与水反应”的实验,并进行了其他有关实验.(图中夹持及尾气处理装置均已略去)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
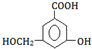
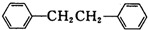 )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
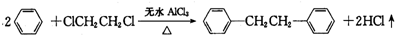
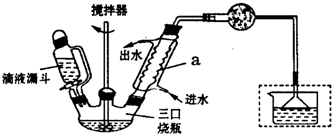
| 名称 | 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
| 1,2-二氯化烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶水,可溶苯 |
| 无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水分解,微溶苯 |
| 联苄 | 182 | 0.98 | 52 | 284 | 难溶水,易溶苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 用蒸发的方法使NaCl从溶液中析出时,玻璃棒的作用是引流 | |
| C. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶的液面以下 | |
| D. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com