
| 化合物 | Fe(OH)2 | Fe(OH)3 | FePO4 | Fe3(PO4)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-22 | 10-36 |
分析 (1)根据化合物中各元素化合价代数和为零分析,可以判断钛元素化合价为+4价;钛铁矿的主要成分为钛酸亚铁(FeTiO3),根据流程可知,钛酸亚铁与稀盐酸反应生成了水和FeTiOCl4;KSCN与Fe3+作用使溶液显血红色,与Fe2+作用无此现象,依此进行分析判断;
(2)向滤液中加入H2O2和NH4H2PO4得到FePO4,过氧化氢氧化亚铁离子,与磷酸根离子形成沉淀,据此分析应采取的正确措施,物质的Ksp越小,越容易形成沉淀;
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2,NaH2PO2为正盐,H3PO2为一元酸;一般来说,金属元素与非金属元素形成离子键,同种非金属元素之间形成极性共价键,不同非金属元素之间形成极性共价键;H2C2O4中的碳为+3价,具有还原性;
(4)充电时,为电解池,阳极LiFePO4发生氧化反应;
(5)①用石墨做阳极,碳不断被生成的氧气氧化;②根据钛元素质量守恒计算至少需要该种钛铁矿的质量.
解答 解:(1)钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),铁的化合价为+2价,氧元素的化合价为-2价,设钛元素的化合价为x,根据化合物中各元素化合价的代数和为零的规律,可得+2+x+(-2)×3=0;解之得x=+4,根据工艺流程可知,FeTiO3与稀盐酸反应生成了水和FeTiOCl4,反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O,KSCN与Fe3+作用使溶液显红色,与Fe2+作用无此现象,故先滴加KSCN溶液,不显血红色,说明原溶液不含有Fe3+;再加入过氧化氢,溶液显血红色,说明溶液中有Fe3+生成,即过氧化氢氧化亚铁离子,说明原溶液中含有Fe2+,
故答案为:+4;FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O;先滴加KSCN溶液,不显血红色,再加入过氧化氢,溶液显血红色;
(2)a.FePO4中的铁为+3价铁,加H2O2 目的氧化亚铁离子且不引入新的杂质,不加H2O2 无法氧化得不到FePO4,故a不选;
b.Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全,残留在溶液中的c(Fe3+)<10-5mol•L-1;Ksp=c(Fe3+)c3(OH-)=10-5×c3(OH-)=1×10-38 c(OH-)=1×10-11mol/L,c(H+)=1×10-3mol/L,即PH>3即可形成沉淀,调节溶液pH至5,得到氢氧化铁沉淀,不利于FePO4的生成,故b不选;
c.磷酸为中强酸,降低反应温,不利于NH4H2PO4的电离,不利于FePO4的生成,故c不选;
d.增大NH4H2PO4的用量,增大磷酸根的浓度,有利于FePO4的生成,故d选;
故答案为:d;
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2,说明次磷酸中只能电离出一个氢离子,电离方程式为:H3PO2?H++H2PO2-,为一元强酸,在LiFePO4中Li+、Fe2+,与PO43-形成离子键,PO43-中磷和氧形成共价键,H2C2O4中的碳为+3价,在制备LiFePO4的过程中加入H2C2O4的作用是还原FePO4,将+3价铁还原成+2价的铁,
故答案为:一;离子键、共价键;还原FePO4;
(4)充电时,为电解池,根据部分LiFePO4转化为Li1-xFePO4,可知阳极的电极反应式为:LiFePO4-xe-═Li1-xFePO4+xLi+,
故答案为:LiFePO4-xe-═Li1-xFePO4+xLi+;
(5)①电化学还原TiO2,阳极发生:2O2--4e-═O2↑,C+O2=CO2,碳不断被生成的氧气氧化,因此电解过程中,阳极不断被消耗而需要定期更换,
故答案为:2O2--4e-═O2↑,C+O2=CO2;
②设至少需要该种钛铁矿质量为m,根据钛元素质量守恒,则$\frac{m×80%×1{0}^{3}g}{152g/mol}$×76%×48g/mol=12×103g,解得m=6.25×104g=62.5kg,
故答案为:62.5.
点评 本题考查了LiFePO4的制取,涉及沉淀溶解平衡、电解池工作原理、化学方程式书写等知识,题目难度中等,注意掌握电解池工作原理,注意把握题中信息,能够正确提取题中信息,联系所学知识进行解答,试题充分培养了学生的分析、理解能力及灵活应用所学知识的能力.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:多选题
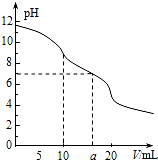 常温下,用 0.1mol•L-1 HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用 0.1mol•L-1 HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | 当V=0时:c(CO32-)>c(HCO3-)>c(OH-)>c(H2CO3) | |
| B. | 当V=5时:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+) | |
| C. | 当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能够节约原料和能源 | B. | 能提高产品的产量 | ||
| C. | 能够提高化学反应速率 | D. | 能够提高经济效益 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2S和Na2O2的混合物中含有的阴离子数目大于0.1NA,小于0.2NA | |
| B. | 常温下0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| C. | 标准状况下,2.24L CHCl3的分子数为0.1NA | |
| D. | 19gT35Cl和H37Cl的混合物中所含中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
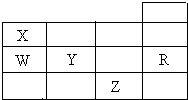 如表为元素周期表前四周期的一部分,X、W、Y、R、Z分别代表元素符号,其中R元素的原子每个电子层都达到稳定结构.下列叙述中正确的是( )
如表为元素周期表前四周期的一部分,X、W、Y、R、Z分别代表元素符号,其中R元素的原子每个电子层都达到稳定结构.下列叙述中正确的是( )| A. | XZ3是平面正三角形分子 | |
| B. | 钠与X形成的化合物Na3X和NaX3都是含有共价键的离子晶体 | |
| C. | W与Y元素的最高价氧化物对应的水化物酸性前者弱于后者 | |
| D. | X的氢化物比W的氢化物稳定,但沸点前者比后者低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z三种元素位于元素周期表中的同一周期 | |
| B. | X、Y、Z三种元素的原子半径依次减小 | |
| C. | X、Y、Z三种元素的原子序数大小为Y>Z>X | |
| D. | 若m>n.则Xm+的半径大于Zn+的半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
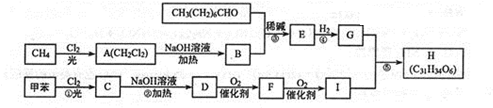
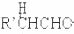 $\stackrel{稀碱}{→}$
$\stackrel{稀碱}{→}$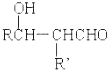
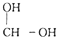 -OH$\stackrel{-H_{2}O}{→}$RCHO
-OH$\stackrel{-H_{2}O}{→}$RCHO .
. .
.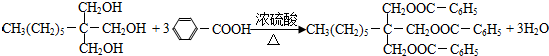 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
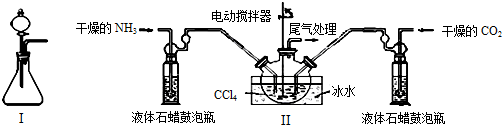
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置. | 溶液变浑浊,则证明固体中含有(NH4)2CO3. |
| 步骤3:取步骤2的上层清液于试管中加入少量的Ba(OH)2溶液. | 溶液不变浑浊,则证明固体中不含有NH4HCO3. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com