
【题目】用下图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是
选项 | 甲 | 乙 | 丙 | 试管中现象 |
A | 浓盐酸 | 二氧化锰 | 石蕊溶液 | 先变红后褪色 |
B | 浓氨水 | 生石灰 | A1Cl3溶液 | 先沉淀后消失 |
C | 醋酸 | 碳酸钙 | BaC12溶液 | 变浑浊 |
D | 浓硝酸 | 铜 | 水 | 试管口出现红棕色 |
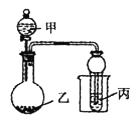
A. A B. B C. C D. D
【答案】D
【解析】
A.浓盐酸与MnO2在加热时发生反应产生Cl2。该装置为加热,反应不能发生。故A错误;
B.把浓氨水滴加在生石灰上,由于CaO与水发生反应,消耗水,产生的Ca(OH)2溶解放热,会加速氨水的分解,产生氨气。把氨气通入到A1Cl3溶液中,发生反应:Al3++3NH3+3H2O=3NH4++Al(OH)3↓。因为NH3·H2O是弱碱,不能溶解产生的Al(OH)3沉淀。因此现象有误。故B错误;
C.把醋酸加入到碳酸钙中,发生反应:2CH3COOH+CaCO3=(CH3COO)2Ca+ H2O+ CO2↑。把气体通入到BaC12溶液中时,因为酸性HCl>H2CO3。所以不会发生反应,试管中不会出现浑浊现象。故C错误;
D.浓硝酸在常温下与Cu发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 。3NO2+H2O = 2HNO3+NO。O2+2NO=2NO2。NO2是红棕色的气体。故D正确。
故选D。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】完成下列流程图。
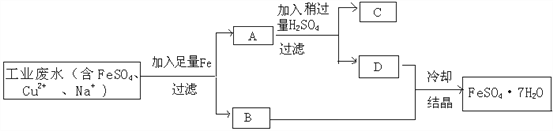
(1)其中,滤渣A中有______________,滤液D中溶质有________________。(填化学式)
(2))加入Fe的目的是_______________________________________。(用化学方程式表示)
(3)加入H2SO4的目的是____________________________________。(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化是人类文明的瑰宝,古代文献中记载了大量古代化学的研究成果。回答下面问题。
(1)我国最原始的陶瓷约出现在距今12000年前,制作瓷器所用的原料是高岭士,其晶体化学式是Al4[Si4O10](OH)8,用氧化物表示其组成为____。
(2)《本草纲目》中记载:“(火药)乃焰消( KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者。”反应原理为:S+2KNO3+3C![]() K2S+N2↑+2CO2↑,该反应的氧化剂是____ ,反应转移4mol电子时,被S氧化的C有____mol。
K2S+N2↑+2CO2↑,该反应的氧化剂是____ ,反应转移4mol电子时,被S氧化的C有____mol。
(3)我国古代中药学著作《新修本草》记载的药物有844种,其中有关“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑁璃…烧之赤色…。”我国早期科技丛书《物理小适-金石类》 记载有加热青矾时的景象:“青矾厂气熏人,衣服当之易烂,载木不盛。”青矾就是绿矾( FeSO4·7H2O)。根据以上信息,写出“青矾”受热分解的化学方程式____
(4)中国古代第一部药物学专著《神农本革经》记载:“石硫磺(S)…主阴蚀疽痔恶血,坚筋骨,除头秃,能化金银铜铁奇物。”根据以上信息,得出硫磺(S)具有的性质或用途是 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为___________________________。
(2)已知反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
温度(℃) | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
①该反应的化学平衡常数K的表达式为____________,a________0(填“>”、“<”或“=”)。在500 ℃ 2 L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为________,生成CO的平均速率v(CO)为_______________。
②700 ℃反应达到平衡后,要使反应速率增大且平衡向右移动, 可采取的措施有 ___________。
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式_____________________,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=_________(溶液电解前后体积的变化忽略不计)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化碘的化学式为ICl,性质和溴非常相似。下列关于ICl的有关说法中不正确的是( )
A. I与Cl之间形成的化学键为共价键
B. ICl分子为共价化合物分子
C. 该物质在反应中通常体现氧化性
D. ICl在反应ICl+2NaOH![]() NaCl+NaIO+H2O中作氧化剂
NaCl+NaIO+H2O中作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池应用广泛。该锂电池将锂嵌入碳材料,含Li+导电固体为电解质;电解质中迁移介质是一种有机聚合物,其单体之一M结构简式如下图:

M的结构简式
电池反应为:LiC6+FePO4![]() LiFePO4+6C
LiFePO4+6C
下列说法正确的是
A.放电时,体系中的Li+向负极移动
B.放电时,FePO4作正极发生氧化反应
C.充电时,与电源正极相连的电极反应为:LiFePO4-e-==Li++FePO4
D.1 mol有机物M与足量NaOH溶液反应,消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.铜的化学性质活泼,不宜用铜制作盛食品的器皿
B.铜的导电能力不如铝
C.由于Cu2+有氧化性,所以用CuSO4来配制农药
D.因为Cu2+能使蛋白质变性,所以铜盐溶液有毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出或完成下列热化学方程式。
(1)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ 的热量。写出CH4燃烧的热化学方程式_____。
(2)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。下表是一些化学键的键能。
化学键 | C-H | C-F | H-F | F-F |
键能kJ/mol | 414 | 489 | 565 | 155 |
根据键能数据估算下列反应:CH4(g) + 4F2(g)=CF4(g) + 4HF(g)的反应热△H为_____。
(3)1840年瑞士的化学家盖斯(Hess)在总结大量实验事实(热化学实验数据)的基础上提出:“定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。”
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
请写出CO还原FeO的热化学方程式:_____。
(4)在恒温(500K)、体积为1.0L 的密闭容器中通入1.0 mol N2和1.0 mol H2发生合成氨反应N2 + 3H2![]() 2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为_____。
2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com