
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某溶液中先滴加氯水,再滴加少量KSCN溶液 | 溶液变成血红色 | 溶液中含有Fe2+ |
| B | AgCl沉淀中滴入稀KI溶液 | 有黄色沉淀出现 | AgI比AgCl更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 淀粉与稀H2SO4共热,再加银氨溶液水浴加热 | 无银镜生成 | 淀粉水解产物无还原性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.滴加试剂顺序错误;
B.发生沉淀的转化;
C.铝溶于稀硝酸;
D.银镜反应应在碱性条件下进行.
解答 解:A.滴加试剂顺序错误,应先加KSCN,如无现象,再滴加氯水,如溶液变为红色,可说明含有亚铁离子,故A错误;
B.AgCl沉淀中滴入稀KI溶液有黄色沉淀出现,发生沉淀的转化,所以Ksp(AgI)<Ksp(AgCl),故B正确;
C.铝与浓硝酸发生钝化反应,但溶于稀硝酸,故C错误;
D.银镜反应应在碱性条件下进行,题中没有加入碱调节溶液pH,故D错误.
故选B.
点评 本题考查化学实验方案的评价,涉及物质的检验、沉淀转化等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握实验的严密性和合理性,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑(取代反应) | |
| B. | CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH(加成反应) | |
| C. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O(取代反应) | |
| D. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O(加成反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
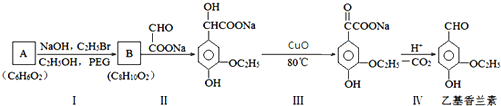
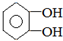 .
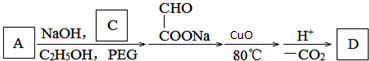
.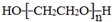 .若PEG的平均相对分子质量为17618,则其平均聚合度约为400.
.若PEG的平均相对分子质量为17618,则其平均聚合度约为400.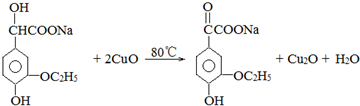 .
.
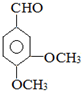 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应Ⅰ的离子方程式为2OH-+Al2O3═2AlO2-+H2O | |
| B. | 操作a的内容包括:通入过量CO2、过滤、洗涤、灼烧 | |
| C. | 操作b为电解熔融状态的Al2O3或用CO还原Al2O3 | |
| D. | 固体b灼烧后与铝反应可用于工业上冶炼相应的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |
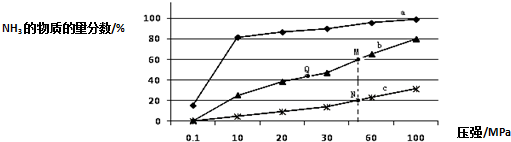
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
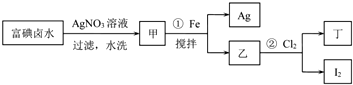
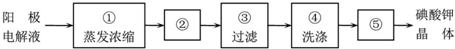
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol/L Na2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存 | |
| B. | 常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3- | |
| C. | 清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+CO32-(aq)?SO42-(aq)+CaCO3(s) | |
| D. | 向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-+Al3++3OH-═BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
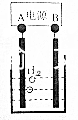 用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.| A. | 图中电源的A极为直流电源的负极 | |
| B. | 加入金属钠可以将酸转化为钠盐,提高离子浓度,增强导电性 | |
| C. | 阳极电极反应为:2C6H13COO--2e-=C12H26+2CO2↑ | |
| D. | 反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com