
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )。

A.蓝色石蕊试纸先变红后退色
B.品红试纸、沾有酸性KMnO4溶液的滤纸均退色,证明SO2具有漂白性
C.湿润淀粉?KI试纸未变蓝说明SO2的氧化性弱于I2
D.NaCl溶液可用于除去实验中多余的SO2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
下列各组顺序的排列不正确的是( )
A.原子半径:Na > Mg > Al > H B.热稳定性: HCl < H2S < PH3
C.酸性强弱:H2SiO3 < H2CO3 < H3PO4 D.氧化性:K+ < Na+ < Mg2+ < Al3+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版4.1硅 无机非金属材料练习卷(解析版) 题型:实验题
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用过量的碳还原二氧化硅制得粗硅,同时得到一种可燃性气体;
②粗硅与干燥的HCl气体反应制得SiHCl3(Si+3HCl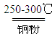 SiHCl3+H2);
SiHCl3+H2);
③SiHCl3与过量的H2在1 100~1 200 ℃的温度下反应制得纯硅,已知SiHCl3能与水剧烈反应,在空气中易自燃。
请回答:
(1)第一步制取粗硅的化学反应方程式为 。
(2)粗硅与HCl气体反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为 。
(3)实验室用SiHCl3与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去):
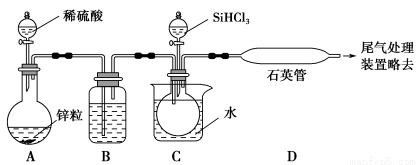
①装置B中的试剂是 ,装置C中的烧杯需要加热,目的是 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式是 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版3.4海水中的元素练习卷(解析版) 题型:选择题
托盘天平两盘内分别放入一个质量相同的烧杯,烧杯里有200 mL 1.00 mol·L-1的盐酸,天平平衡。向烧杯中分别加入下列各组中的两种金属(每个烧杯只放其中一种金属),反应结束后,天平仍保持平衡的是( )。
A.8 g Mg和8 g Al
B.1 g Mg和1 g Al
C.0.1 mol Mg和0.1 mol Al
D.1.8 g Mg和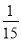 mol Al
mol Al
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版3.3硫的转化练习卷(解析版) 题型:实验题
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
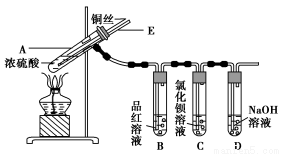
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为 。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是 。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 |
|
|
写出其中SO2表现还原性的离子反应方程式: 。
(4)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是 。
(5)实验完毕后,装置中残留的气体有毒,不能打开导管上的胶塞。为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是 。
(6)将SO2气体通入含有n mol Na2S的溶液中,充分反应后,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体 mol(不考虑溶解的SO2)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版3.3硫的转化练习卷(解析版) 题型:选择题
2012年3月13日,一艘运载7 000吨浓硫酸的韩国籍货船在汕尾海域发生自沉,船上18名外籍船员被救起。下列有关说法正确的是( )。
A.浓硫酸易挥发,从沉船中抽出的浓硫酸要密封保存
B.抽出的浓硫酸有很强的氧化性,不能直接保存在铁制容器中
C.在打捞时,如果盛装浓硫酸的舱室内进水,可能会发生爆炸
D.硫酸工业尾气虽然无害,但它的过度排放会造成温室效应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版3.2氮的循环练习卷(解析版) 题型:选择题
已知HNO2在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。
pH范围 | >7 | <7 |
产物 | NO3- | NO、N2O、N2中的一种 |
下列有关说法错误的是( )。
A.碱性条件下,NaNO2与NaClO反应的离子方程式为NO2-+ClO-=NO3-+Cl-
B.向冷的NaNO2溶液中通入CO2可得到HNO2
C.向冷的NaNO2溶液中加入稀硫酸可得到HNO2
D.向冷的NaNO2溶液中加入滴有淀粉的氢碘酸,溶液变蓝色
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版2.5铁及其化合物练习卷(解析版) 题型:填空题
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是 ;Y与过量浓硝酸反应后溶液中含有的盐的化学式为 。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是 。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
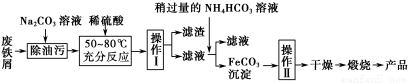
回答下列问题:
①操作Ⅰ的名称是 ;操作Ⅱ的名称是 ;操作Ⅱ的方法为 。
②请写出生成FeCO3沉淀的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学题型冲刺练习 突破离子反应的三个角度(解析版) 题型:选择题
可溶性化合物A、B、C由下表中离子组合而成(每种离子只存在于一种化合物中)。
阳离子 | Mg2+、Ag+、Na+ |
阴离子 | NO3-、SO42-、Cl- |
现将等物质的量的A、B、C一起溶于水后,所得混合溶液中除H+、OH-外还含有五种离子。则A的化学式不可能是( )
A.AgNO3 B.Na2SO4 C.MgCl2 D.MgSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com