
| A. | 等于18s | B. | 等于12s | C. | 大于18s | D. | 小于18s |
分析 先根据v=$\frac{△c}{△t}$计算出20s内的平均反应速率,再利用此反应速率计算出反应物浓度由0.06mol/L降到0.036mol/L的浓度变化消耗的反应时间,由于反应物浓度减小,反应速率减小,反应消耗的时间越大.
解答 解:前20s反应H2?2H的平均反应速率为v=$\frac{0.1mol/L-0.06mol/L}{20s}$=0.002mol/(L•s),
反应物浓度由0.06mol/L降到0.024mol/L,浓度变化为0.06mol/L-0.024mol/L=0.036mol/L,
按照前20s的平均反应速率计算,反应消耗的时间为$\frac{0.036mol/L}{0.002mol/(L•s)}$=18s,
由于反应物浓度越小,反应速率越小,所以反应需要的时间大于18s,
故选C.
点评 本题考查了化学反应速率的计算,题目难度中等,关键是理解随着反应的进行,反应物的难度逐渐降低,从而导致反应速率逐渐降低这一客观事实,然后列式计算即可.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | Al | B | Be | C | Cl | X | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Y | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
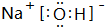 、该物质中的化学键为离子键、共价键.
、该物质中的化学键为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
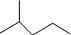 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.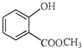 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.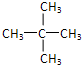 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用品 |  |  |  聚乙烯盒 |  |
| 成分 | (NH4)2SO4 | Na2CO3 |  | Fe2O3 |
| 用途 | 化肥 | 制玻璃 | 盛放食品 | 涂料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
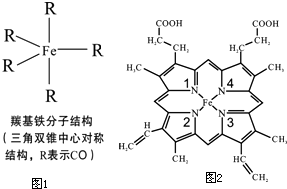 Fe、C、N、O、H可以组成多种物质.回答以下问题:
Fe、C、N、O、H可以组成多种物质.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
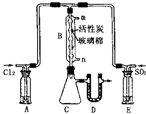 已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g)=SO2C12(g)△H<0,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.
已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g)=SO2C12(g)△H<0,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com