
| A. | V L该气体的质量(以g为单位) | B. | 1 L该气体的质量(以g为单位) | ||
| C. | 1 mol该气体的体积(以L为单位) | D. | 1 L该气体的物质的量(以mol为单位) |
分析 根据题给条件,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X,则气体物质的量n=$\frac{x}{{N}_{A}}$mol,乘以气体摩尔质量得到气体的质量,再除以气体体积得到的是气体的密度.
解答 解:A、以g为单位VL,该气体的质量为:n=$\frac{x}{{N}_{A}}$mol×M g•mol-1,故A错误;
B、以g为单位1L该气体的质量即气体的密度=$\frac{x}{{N}_{A}}$mol×M g•mol-1/VL=$\frac{MX}{V{N}_{A}}$,故B正确;
C、该气体的物质的量为:n=$\frac{x}{{N}_{A}}$mol,体积为V L,1mol该气体的体积是$\frac{V{N}_{A}}{x}$,故C错误;
D、由于V L的该气体所含有的分子数为X,故1L气体中含有的分子数为$\frac{x}{V}$个,则物质的量为$\frac{\frac{x}{V}}{{N}_{A}}$=$\frac{x}{V{N}_{A}}$mol,故D错误.
故选B.
点评 本题考查了物质的量与微粒数、质量、摩尔质量、气体体积、阿伏伽德罗常数等物理量之间的关系和计算.


科目:高中化学 来源: 题型:选择题
| A. | Fe→Fe2O3→Fe(OH)3 | B. | SO2→SO3→H2SO4 | ||
| C. | FeCl2→Fe(OH)2→Fe(OH)3 | D. | NO→NO2→HON3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 丹参素在C上取代H的一氯代物有4种 | |
| B. | 在Ni催化下1mol丹参素最多可与4molH2加成 | |
| C. | 丹参素能发生取代、消去、中和、氧化等反应 | |
| D. | 1mol丹参素在一定条件下与足量金属钠反应可生成4molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属阳离子与自由电子间的作用较弱 | |
| B. | 金属在外加电场作用下可失去电子 | |
| C. | 金属阳离子在外加电场作用下可发生定向移动 | |
| D. | 自由电子在外加电场作用下可发生定向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
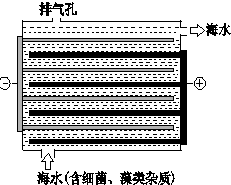 海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素.
海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素.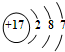 ,碘在元素周期表中的位置是第五周期ⅦA族,HI的稳定性比HBr弱(填写“强”或“弱”).
,碘在元素周期表中的位置是第五周期ⅦA族,HI的稳定性比HBr弱(填写“强”或“弱”).| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尿素CO(NH2)2 | B. | NH4NO3 | C. | NH4HCO3 | D. | (NH4)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaHCO3固体加入新制氯水,有无色气泡(H+) | |
| B. | 使红色布条褪色(Cl2) | |
| C. | 氯水能够导电(ClO) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com