
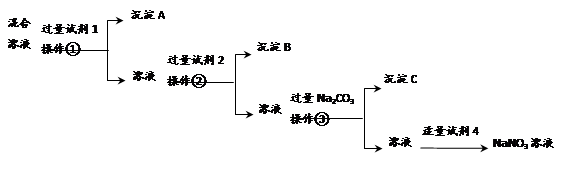


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,______________________ | ____________,说明悬浊液中混有Cu4(OH)6SO4 |
| 步骤2:另取少量悬浊液于试管中,____________________ | ____________,说明悬浊液中混有Cu(OH)2 |
查看答案和解析>>
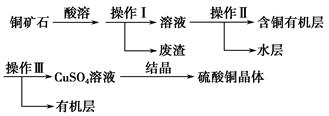
科目:高中化学 来源:不详 题型:实验题
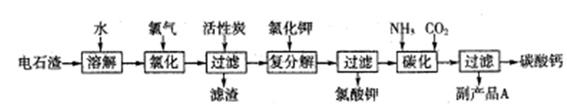

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
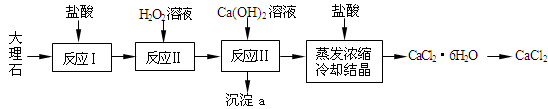
查看答案和解析>>
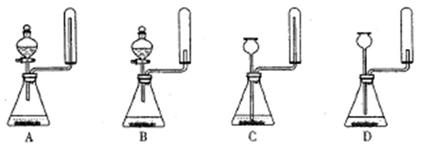
科目:高中化学 来源:不详 题型:实验题
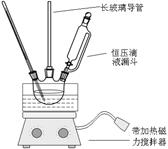
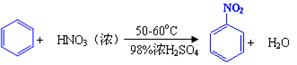
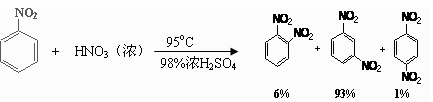
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃) / g·cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 |  | 83 | 1.4 | 易溶于水 |
| 浓硫酸 |  | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 操作 | 现象 | 结论 |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| D | 加入稀盐酸,将产生的气体通入澄清石灰水中 | 溶液变浑浊 | 原溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入滴加BaCl2溶液,立即产生白色沉淀。 | 原溶液中一定有SO42- |
| B | 在K2CrO7溶液中加入NaOH溶液,溶液由橙色变为黄色。 | K2CrO7与NaOH溶液发生了氧化还原反应 |
| C | 在滴有酚酞的Na2CO3溶液中,滴加入BaC12溶液,溶液红色逐渐褪去。 | Na2CO3溶液中存在水解平衡 |
| D | 用铂丝蘸取溶液进行颜色反应,观察到火焰呈黄色。 | 该溶液一定是钠盐溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com