
在强酸性溶液中能大量共存的离子组是
A.K+、Na+、NO3-、CO32-
B.K+、Na+、Br-、SO32-
C.K+、Na+、I-、SO42-
D.Na+、K+、CH3COO-、SO42-
科目:高中化学 来源:2014秋贵州省遵义市高二上学期期中化学(文)试卷(解析版) 题型:选择题
葡萄糖作为营养剂供给人体能量,在体内发生主要的反应是
A.氧化反应 B.取代反应
C.加成反应 D.聚合反应
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高二上学期期中联考化学试卷(解析版) 题型:填空题
(12分)中和热的测定是高中重要的定量实验。取0.55 mol/L的NaOH溶液50 mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题
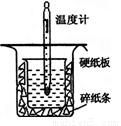
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是_________ _,除此之外,装置中的一个明显错误是 。
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热数值会_________,(填“偏大”、“偏小”或“不变”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求中和热 (填“相等”或“不相等”),简述理由: 。
(4)某实验小组用盐酸和氢氧化钠溶液做了三次实验,每次取溶液各50 mL,并记录下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
2 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
3 | 25.1 | 25.1 | 25.1 | 27.1 | 2.0 |
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容c=4.18×10-3 kJ/(g·℃),根据计算结果,写出该中和反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:计算题
(6分)在标准状况下,用一定量的水吸收氨气后得到浓度为12.0 mol/L密度为0.915g·cm-3的氨水,试计算(要求写出计算过程):
(1)该氨水溶质的质量分数ω是多少?(用百分数表示,保留到小数点后一位数)
(2)1 L水吸收标准状况下的氨气多少升可制得上述氨水?(水的密度以1.00g·cm-3计,计算结果取整数。)
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:选择题
硫酸钾和硫酸铝的混合溶液,已知其中Al3+的浓度为0.4 mol/L,硫酸根离子浓度为0.7 mol/L,则K+的物质的量浓度为
A.0.1 mol/L B.0.15 mol/L
C.0.3 mol/L D.0.2 mol/L
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:选择题
下列叙述正确的是
①氧化还原反应的实质是电子的得失。
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下。
③标准状况下,1 L HCl和1 L H2O的物质的量相同。
④溶于水得到的溶液可以导电的化合物就是电解质。
⑤利用丁达尔现象区别溶液和胶体。
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同。
⑦在同温同体积时,气体物质的物质的量越大,则压强越大。
⑧同温同压下,气体的密度与气体的相对分子质量成正比。
A.①②③④ B.②③⑥⑦⑧ C.⑤⑦⑧ D.④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:填空题
(10分)某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
实验编号 | 0.01mol·L-1 酸性KMnO4溶液 | 0.1mol·L-1 H2C2O4溶液 | 水 | 1mol·L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
I | 2mL | 2mL | 0 | 0 | 20 | 125 |
II | ____mL | ____mL | 1mL | 0 | 20 | 320 |
III | ____mL | __ _mL | ___mL | 0 | 50 | 30 |
IV | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
已知:反应的方程式(未配平):KMnO4 + H2C2O4 + H2SO4 —— K2SO4 + MnSO4 + CO2↑+ H2O
(1)实验记时方法是从溶液混合开始记时,至___ ___ __时记时结束。
(2)实验I和II研究浓度对反应速率的影响,实验I和III研究温度对反应速率的影响。请在上表空格中填入合理的实验数据。
(3)从实验数据分析,实验I和IV研究________对反应的影响。
(4)请配平上面的化学方程式:
KMnO4 + H2C2O4 + H2SO4= K2SO4 + MnSO4 + CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:选择题
下列说法中正确的是
①化学反应的实质是活化分子有合适取向时的有效碰撞
②普通分子间的碰撞有时也能发生化学反应
③活化分子比普通分子具有较高的能量
④化学反应的实质是原子的重新组合
⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程
⑥活化分子间的碰撞一定能发生化学反应
A.①③④⑤ B.②③⑥ C.③④⑤⑥ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2014秋河北省、临漳一中、永年二中高二上学期期中联考化学试卷(解析版) 题型:选择题
如图由锌—铜—稀H2SO4组成的原电池装置中,当导线中有0.2 mol电子通过时,理论上两极的变化是
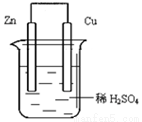
A.铜片增重6.4g B.锌片增重6.5 g
C.铜片上析出0.1 mol O2 D.锌片溶解了6.5 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com