
【题目】元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、 [Cu(NH3)4]2+(深蓝色)等形式存在。CuCl为难溶于水的白色固体。回答下列问题:
(1)在浓的强碱溶液中,Cu2+与Al3+的化学性质相似。在少量的CuSO4溶液中,逐渐加入浓的NaOH溶液直至过量,可观察到的现象是_____________________。
(2)CuCl溶于浓盐酸时发生的反应为CuCl+HCl![]() H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是___________________。在热的CuCl2溶液中加入铜粉,可制得CuCl,其反应的离子方程式为___________________,但实际上该反应较难持续进行,其原因是____________________,使反应彻底进行的操作是___________________。
H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是___________________。在热的CuCl2溶液中加入铜粉,可制得CuCl,其反应的离子方程式为___________________,但实际上该反应较难持续进行,其原因是____________________,使反应彻底进行的操作是___________________。
(3)[Cu(H2O)4]2+和[Cu(NH3)4]2+在溶液中可以相互转化。:t℃时,初始浓度为1molL-1的CuSO4溶液中{ Cu2+实际以[Cu(H2O)4]2+的形式存在},[Cu(NH3)4]2+的浓度随氨水浓度[c(NH3)]的变化如图所示
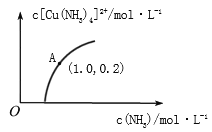
①CuSO4溶液与过量氨水发生反应的总的离子方程式为________________。
②由图可知,溶液的酸性增大,[Cu(H2O)4]2+ 转化为[Cu(NH3)4]2+的平衡转化率___________(填“增大”“减小”或“不变”)。根据A点数据,计算出该温度下的平衡常数K=__________。
③升高温度,溶液中[Cu(H2O)4]2+的平衡转化率减小,则该反应的ΔH_____(填“>”“<”或“=”)0
④硫酸四氯合铜{[Cu(NH3)4]SO4}在碱性镀铜工艺中常用作电镀液的主要成分,电镀时,要控制局部温度不得高于150℃,可能的原因是_______________。电解时。阴极的电极反应式为___________________。
【答案】溶液天蓝色逐渐褪去,同时有蓝色絮状沉淀生成,然后沉淀逐渐溶解形成蓝色溶液加水稀释Cu2++2Cl-+Cu![]() 2CuCl生成的难溶盐CuCl附着在Cu粉的表面,影响反应的继续进行加入浓盐酸使CuCl溶解生成[CuCl2]-[Cu(H2O)4]2++4NH3
2CuCl生成的难溶盐CuCl附着在Cu粉的表面,影响反应的继续进行加入浓盐酸使CuCl溶解生成[CuCl2]-[Cu(H2O)4]2++4NH3![]() [Cu(NH3)4]2++4H2O(或[Cu(H2O)4]2++4NH3·H2O
[Cu(NH3)4]2++4H2O(或[Cu(H2O)4]2++4NH3·H2O![]() [Cu(NH3)4]2++8H2O)减小0.25<超过150℃,[Cu(NH3)4]SO4易分解[Cu(NH3)4]2++2e-=Cu↓+4NH3
[Cu(NH3)4]2++8H2O)减小0.25<超过150℃,[Cu(NH3)4]SO4易分解[Cu(NH3)4]2++2e-=Cu↓+4NH3
【解析】(1)由于Cu2+与Al3+的化学性质相似,在CuSO4溶液中逐滴加入NaOH溶液后,先生成蓝色Cu(OH)2沉淀:Cu2++2OH-=Cu(OH)2↓,继续滴加氢氧化钠溶液,蓝色Cu(OH)2沉淀溶解,而由于此反应时非氧化还原反应,故铜元素的化合价不变,即蓝色Cu(OH)2沉淀溶解后应得到蓝色溶液;
(2)加水稀释,平衡CuCl+HCl![]() H[CuCl2]逆向移动,有CuCl沉淀析出,注意如果滴加NaOH溶液,平衡也会逆向移动,但会生成Cu2O沉淀;
H[CuCl2]逆向移动,有CuCl沉淀析出,注意如果滴加NaOH溶液,平衡也会逆向移动,但会生成Cu2O沉淀;
在热的CuCl2溶液中加入铜粉生成CuCl的离子方程式为Cu2++2Cl-+Cu![]() 2CuCl,但由于生成的难溶盐CuCl附着在Cu粉的表面,阻止反应的继续进行,故实际该反应较难持续进行;为使反应彻底进行可加入浓盐酸使生成的CuCl溶解生成[CuCl2]-;
2CuCl,但由于生成的难溶盐CuCl附着在Cu粉的表面,阻止反应的继续进行,故实际该反应较难持续进行;为使反应彻底进行可加入浓盐酸使生成的CuCl溶解生成[CuCl2]-;
(3)①CuSO4溶液与过量氨水生成[Cu(NH3)4]2+的离子方程式为Cu(H2O)4]2++4NH3·H2O![]() [Cu(NH3)4]2++8H2O;
[Cu(NH3)4]2++8H2O;
②由图可知,溶液的酸性增大,NH3·H2O+H+=NH4++H2O,则平衡逆向移动,[Cu(H2O)4]2+ 转化为[Cu(NH3)4]2+的平衡转化率减小;A点[Cu(NH3)4]2+的浓度为0.2mol/L,则消耗的Cu(H2O)4]2+的浓度为0.2mol/L,则溶液中的c(Cu(H2O)4]2+)=1.0mol/L-0.2mol/L=0.8mol/L,NH3浓度为1.0mol/L,此时该转化反应的平衡常数为 K=![]() =0.25;
=0.25;
③升高温度,溶液中[Cu(H2O)4]2+的平衡转化率减小,说明升温平衡逆向移动,正方向为放热反应,即该反应的ΔH<0;
④温度高于150℃时硫酸四氯合铜易分解,则电镀时,要控制局部温度不得高于150℃;电解时,阴极发生的还原反应的电极反应式为[Cu(NH3)4]2++2e-=Cu↓+4NH3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】AF是几种烃分子的球棍模型(如下图所示),据此冋答下列问题:
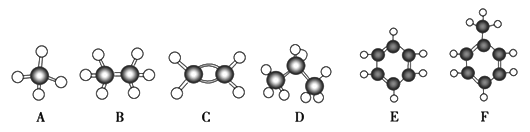
(1)含碳量最高的烃是(填对应字母)____________________
(2)能够发生加成反应的烃有(填对应字母)__________________
(3)写出F与液溴反应的化学方程式__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是铜与稀硝酸反应的两个实验装置图,请按要求回答问题:
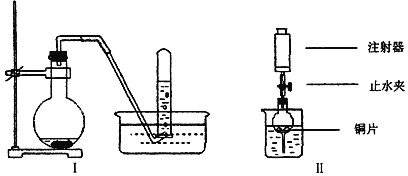
(1)铜与稀硝酸反应的离子方程式为_____________________________________________。
(2)I实验装置中能否证明铜与稀硝酸反应生成的是NO气体_______(选填“能”或“不能”), 简述理由_____________________________。
(3)若用Ⅱ实验装置进行实验,以证明铜与稀硝酸反应生成的气体是NO,则检查气密性的操作是______________________________________________________________________________。
(4)在Ⅱ实验装置的烧杯中加入一定体积的稀硝酸,打开止水夹,用注射器慢慢抽取干燥管内的空气,稀硝酸沿着干燥管慢慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,此时观察干燥管内的现象是________________________________________;反应停止后,打开止水夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水夹后取下注射器,并抽取一定量的空气,此时观察到的现象是____________________________________________。
(5)上述实验完成后,将注射器内的气体通入到NaOH溶液中,其目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是
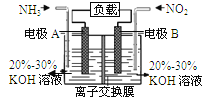
A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-=N2+6H+
D. 当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下面装置设计实验,制备SO2并进行探究。
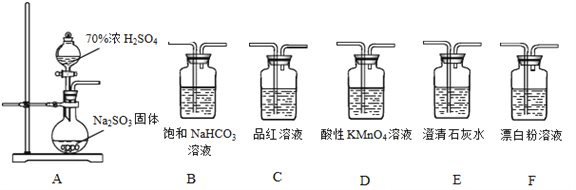
(1)装置A中反应的化学方程式:__________________。
(2)将A中产生的SO2持续通入装置G中直至过量。
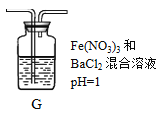
①G中有白色沉淀生成,其化学式为_________。
②写出反应初始时SO2被氧化的离子方程式:________________。
(3)选用A~F中的装置验证H2SO4的酸性强于H2CO3,能作为依据的实验现象是:________。
(4)要证明H2SO3的酸性强于HClO,所选装置(A~F中)的连接顺序为(填序号):A__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氧气和臭氧是同素异形体,因氧原子的个数和成键方式不同,造成了两者性质差异
B. 氕、氘、氚是三种不同的元素,且互为同位素
C. CH3COOCH2CH3和CH3CH2OOCCH3是不同种物质
D. C3H8的一氯取代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡发生移动的是
A. 反应物的转化率 B. 反应混合物的浓度
C. 正、逆反应速率 D. 反应混合物的压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com