
| A. | Q1>Q2 | B. | Q1<Q2 | C. | Q1=Q2 | D. | 无法确定 |
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①和③ | C. | 只有② | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+HCl═NaCl+H2O | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | D. | 2Na+2H2O═2NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
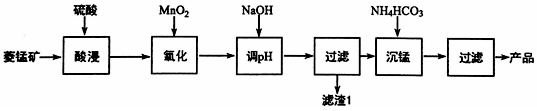
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
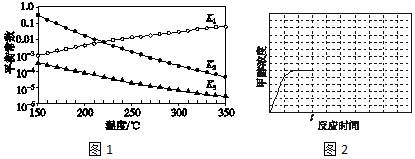
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的转化率为60% | B. | 反应速率v(Y)=0.3 mol/(L•min) | ||
| C. | a的值为2 | D. | 平衡时X的浓度为0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
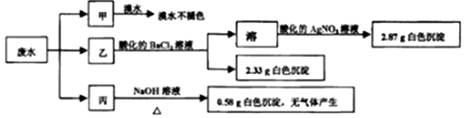
| A. | 废水可能含有Na+、K+、Fe3+ | |
| B. | 可能存在的离子用焰色反应进一步检验确认 | |
| C. | 废水一定含有Cl-、SO42-和Mg2+,且c(Cl-)=0.2mol•L-1 | |
| D. | 废水一定不含 SO32-、Cl-、NH4+、Na+、K+、Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com