
分析 氢氧化钠与氯化铝反应,氢氧化钠少量反应生成氢氧化铝沉淀和氯化钠,氢氧化钠过量反应生成偏铝酸钠和水,由②③可知,一定量的甲与乙反应时,乙的量越多,生成的沉淀越少,则乙为NaOH溶液,即甲为AlCl3溶液;根据①中发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,碱不足来计算NaOH溶液的物质的量浓度;根据②中发生AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,假设出最大沉淀量,并利用生成的沉淀的量来计算AlCl3溶液的浓度;
解答 解:氢氧化钠与氯化铝反应,氢氧化钠少量反应生成氢氧化铝沉淀和氯化钠,氢氧化钠过量反应生成偏铝酸钠和水,由②③可知,一定量的甲与乙反应时,乙的量越多,生成的沉淀越少,则乙为NaOH溶液,即甲为AlCl3溶液,
在①中发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,1.56g沉淀的物质的量为$\frac{1.56g}{78g/mol}$=0.02mol,碱不足,完全反应,
则NaOH的物质的量为0.02mol×3=0.06mol,故NaOH溶液的物质的量浓度为$\frac{0.06mol}{0.12L}$=0.5mol/L,
在②中发生AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,假设出沉淀最大量xmol,开始沉淀过程消耗氢氧根离子3xmol,
沉淀溶解过程氢氧化铝与氢氧化钠1:1反应,最后生成0.02mol氢氧化铝,所以消耗氢氧化钠(x-0.02)mol,
则一共消耗氢氧化钠为3x+(x-0.02)=0.44L×0.5mol/L=0.22mol,解得x=0.06mol,即最多有氢氧化铝0.06mol,所以原溶液含铝离子0.06mol,
氯化铝浓度为$\frac{0.06mol}{0.12L}$=0.5mol/L,
故答案为:AlCl3;氢氧化钠与氯化铝反应,氢氧化钠少量反应生成氢氧化铝沉淀和氯化钠,氢氧化钠过量反应生成偏铝酸钠和水,由②③可知,一定量的甲与乙反应时,乙的量越多,生成的沉淀越少,则乙为NaOH溶液,即甲为AlCl3溶液;
甲溶液的物质的量浓度为0.5mol/L;
点评 本题考查氯化铝与碱的反应,明确氢氧化铝的两性及了利用信息判断过量碱能溶解氢氧化铝、实验中发生的化学反应是解答的关键,难度较大.


科目:高中化学 来源: 题型:选择题
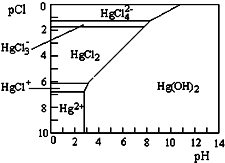 水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )| A. | 正常海水(Cl-的浓度大于0.1mol•L-1)中汞元素的主要存在形态是HgCl42- | |
| B. | 少量Hg(NO3)2溶于0.001mol•L-1的盐酸后,汞元素的主要存在形态是HgCl2 | |
| C. | 将Hg(NO3)2固体直接溶于水中配制溶液 | |
| D. | 可用废铜屑处理含Hg2+的废水,其离子方程式为Cu+Hg2+═Cu2++Hg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,
用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,| 实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
| 1 | 25.00 | 24.41 |
| 2 | 25.00 | 24.39 |
| 3 | 25.00 | 24.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
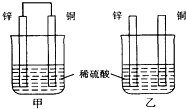
| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的氢离子浓度均减小 | D. | 产生气泡的速度甲比乙慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

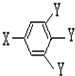 (其中:-X、-Y均为官能团)
(其中:-X、-Y均为官能团)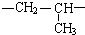
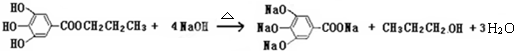
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
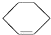 ).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )| A. | ②④⑤⑧ | B. | ②⑤⑧ | C. | ②④⑤⑦ | D. | ②④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径按X、Y、Z的顺序增大 | |
| B. | 单质的氧化性按X、Y、Z的顺序减弱 | |
| C. | 元素的非金属性按X、Y、Z的顺序增强 | |
| D. | 气态氢化物稳定性按X、Y、Z的顺序减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=1的溶液:Ag+、Al3+、Cl-、SO42- | |
| B. | 能使甲基橙溶液变红的溶液:Na+、K+、HCO3-、S2- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液:NH4+、Cu2+、NO3-、Cl- | |
| D. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com