
有如下两个反应:
①2HCl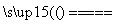 H2+Cl2 ②2HCl
H2+Cl2 ②2HCl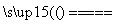 H2↑+Cl2↑
H2↑+Cl2↑
关于这两个反应的叙述中错误的是( )
A.①②两反应都是氧化还原反应
B.①②两反应中的能量转换方式都是热能转变为化学能
C.②反应是电能转变为化学能
D.①反应是热能转变为化学能
科目:高中化学 来源: 题型:
下表中所示物质或概念间的从属关系符合如图的是
|
| X | Y | Z |
| A | 钠元素 | 主族元素 | 短周期元素 |
| B | 电解质 | 化合物 | 纯净物 |
| C | 氢氧化铁 | 胶体 | 分散系 |
| D | 置换反应 | 氧化还原反应 | 放热反应 |
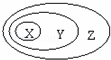
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
由乙烯合成有机物F(二乙酸乙二酯),采用下列合成路线:
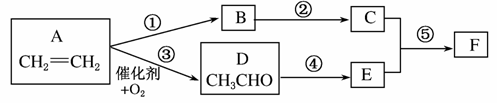
(1)已知有机物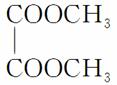 的名称为乙二酸二甲酯。请写出F的结构简式__________。
的名称为乙二酸二甲酯。请写出F的结构简式__________。
(2)在上述反应中属于取代反应的有________(填反应代号)。
(3)A、D、E、F中能引入C中官能团的物质有__________(填反应物代号),其反应⑤的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说法中正确的是( )
A.充电时作阳极,放电时作正极
B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极
D.充电时作阴极,放电时作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应_________________,负极反应_________________。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:________________________________。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式_____________、_______________。
劣质不锈钢腐蚀的实验现象:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
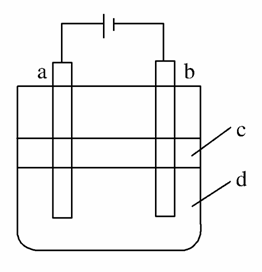
(1)a电极材料为__________,其电极反应式为__________。
(2)电解液d可以是__________,则白色沉淀在电极上生成;也可以是__________,则白色沉淀在两极之间的溶液中生成。
A.纯水 B.NaCl溶液
C. NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是__________,在加入苯之前,对d溶液进行加热处理的目的是_______________________________。
(4)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2SO2(g)+O2(g)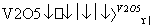 2SO3(g)是制备硫酸的重要反应,下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应,下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=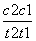
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com