
| 操作和现象 | 结论 | |
| A | 切开金属钠,钠表面银白色会逐渐褪去 | Na在空气中会生成Na2O2 |
| B | 铁棒插入浓硝酸中,无明显现象 | 铁与浓硝酸不反应 |
| C | 将FeCl2溶液滴加到少许酸性KMnO4溶液中,溶液褪色 | FeCl2具有漂白性 |
| D | 向Fe(NO3)2溶液中滴加稀硫酸和KSCN溶液,溶液变成红色 | 原溶液中可能含有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.钠在不加热条件下缓慢氧化生成氧化钠;
B.铁与浓硝酸在常温下发生的钝化现象,不是不反应;
C.氯化亚铁具有还原性,被酸性高锰酸钾溶液氧化;
D.溶液变红,说明此时的溶液中含有铁离子,原溶液中也可能含有铁离子.
解答 解:A.Na在空气中会生成Na2O,所以切开的金属钠表面银白色会逐渐褪去,故A错误;
B.铁与浓硝酸反应生成一层致密的氧化膜,阻止了反应的继续进行,不是不反应,故B错误;
C.将FeCl2溶液滴加到少许酸性KMnO4溶液中,由于FeCl2具有还原性,被酸性高锰酸钾溶液氧化导致溶液褪色,故C错误;
D.向Fe(NO3)2溶液中滴加稀硫酸和KSCN溶液,溶液变成红色,说明反应后溶液中含有铁离子,则原溶液中也可能含有Fe3+,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及常见金属及其化合物性质、离子检验等知识,明确常见元素及其化合物性质为解答关键,注意掌握常见离子的性质及检验方法.


科目:高中化学 来源: 题型:解答题
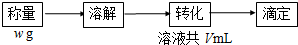
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
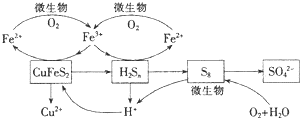
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2能引起温室效应,是一种大气污染物 | |
| B. | 硫是一种黄色晶体,不溶于水,微溶于酒精 | |
| C. | SO2能使品红溶液褪色是因为它具有漂白性 | |
| D. | NO2和SO2是主要的大气污染物,溶于水后可能形成酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第16、17列都是非金属元素 | |
| B. | 第1列金属元素和第17列元素的单质熔、沸点变化趋势相反 | |
| C. | 只有第2列元素原子最外层有2个电子 | |
| D. | 在18列元素中,第3列元素种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
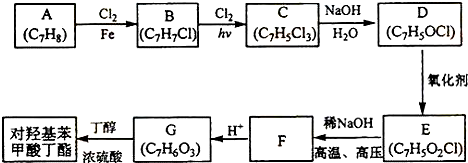
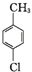 +2Cl2$\stackrel{hv}{→}$
+2Cl2$\stackrel{hv}{→}$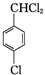 +2HCl,该反应过程中涉及的反应类型是取代反应.
+2HCl,该反应过程中涉及的反应类型是取代反应.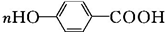 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$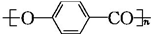 +nH2O.
+nH2O. ,D与银氨溶液发生反应的化学方程式为
,D与银氨溶液发生反应的化学方程式为 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$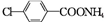 +H2O+2Ag↓+3NH3.
+H2O+2Ag↓+3NH3.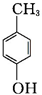 为原料制备G(
为原料制备G(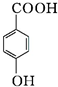 )的合成路线:
)的合成路线: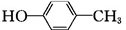 $\stackrel{CH_{3}I}{→}$
$\stackrel{CH_{3}I}{→}$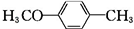 $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$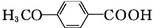 $\stackrel{HI}{→}$
$\stackrel{HI}{→}$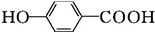 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA | |
| B. | 78克Na2O2含有阴离子数为2NA | |
| C. | 常温下,在18g 18O2中含有氧原子数为NA | |
| D. | 1mol-OH所含的电子数目为7NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com