
 ��D�ĺ˴Ź�������ͼ�н�����4�ַ壻
��D�ĺ˴Ź�������ͼ�н�����4�ַ壻 ��
��
���� A�ķ���ʽΪC5H8H2��1molA�ܹ���2mol���������ӳɷ�Ӧ�����Dz�������ˮ�����ӳɷ�Ӧ��˵��A�в���̼̼˫��������������ת����ϵ��֪��A�ܹ������Ƶ�������ͭ��Ӧ����A�к���ȩ����B�������ӳɷ�Ӧ���ɵ�C�ܹ�����������Ӧ������Ԫ��������C�к����ǻ����Ȼ����ٽ��Aû��֧����֪C�Ľṹ��ʽΪ��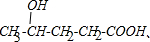 ����A�к���1��ȩ����1���ʻ���A�Ľṹ��ʽΪ��
����A�к���1��ȩ����1���ʻ���A�Ľṹ��ʽΪ��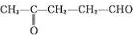 ��BΪ
��BΪ ��C��Ũ������������¼��ȷ�Ӧ����F��F���巢���ӳɷ�Ӧ����G����F�к���1��������F�Ľṹ��ʽΪ��CH3CH=CHCH2COOH��GΪCH3CH��Br��CH��Br��CH2COOH���ݴ˽��н��
��C��Ũ������������¼��ȷ�Ӧ����F��F���巢���ӳɷ�Ӧ����G����F�к���1��������F�Ľṹ��ʽΪ��CH3CH=CHCH2COOH��GΪCH3CH��Br��CH��Br��CH2COOH���ݴ˽��н��
��� �⣺A�ķ���ʽΪC5H8H2��1molA�ܹ���2mol���������ӳɷ�Ӧ�����Dz�������ˮ�����ӳɷ�Ӧ��˵��A�в���̼̼˫��������������ת����ϵ��֪��A�ܹ������Ƶ�������ͭ��Ӧ����A�к���ȩ����B�������ӳɷ�Ӧ���ɵ�C�ܹ�����������Ӧ������Ԫ��������C�к����ǻ����Ȼ����ٽ��Aû��֧����֪C�Ľṹ��ʽΪ��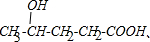 ����A�к���1��ȩ����1���ʻ���A�ṹ��ʽΪ��
����A�к���1��ȩ����1���ʻ���A�ṹ��ʽΪ�� ��BΪ
��BΪ ��C��Ũ������������¼��ȷ�Ӧ����F��F���巢���ӳɷ�Ӧ����G����F�к���1��������F�Ľṹ��ʽΪ��CH3CH=CHCH2COOH��GΪCH3CH��Br��CH��Br��CH2COOH��
��C��Ũ������������¼��ȷ�Ӧ����F��F���巢���ӳɷ�Ӧ����G����F�к���1��������F�Ľṹ��ʽΪ��CH3CH=CHCH2COOH��GΪCH3CH��Br��CH��Br��CH2COOH��
��1��C�Ľṹ��ʽΪ��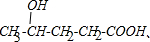 ����C�ķ���ʽΪ��C5H10O3��
����C�ķ���ʽΪ��C5H10O3��
�ʴ�Ϊ��C5H10O3��
��2�����ݷ�����֪��A�Ľṹ��ʽΪ�� ��
��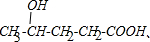 ����������������Ӧ����D����D�Ľṹ��ʽΪ��
����������������Ӧ����D����D�Ľṹ��ʽΪ��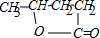 ��������к���4�ֵ�ЧHԭ�ӣ�������˴Ź���������4�����շ壬
��������к���4�ֵ�ЧHԭ�ӣ�������˴Ź���������4�����շ壬
�ʴ�Ϊ�� ��4��
��4��
��3��GΪCH3CH��Br��CH��Br��CH2COOH��������к��й�����Ϊ��ԭ�Ӻ��Ȼ���
�ʴ�Ϊ����ԭ�ӡ��Ȼ���
��4��B��C�ķ�ӦΪ �����������ӳɷ�Ӧ����
�����������ӳɷ�Ӧ����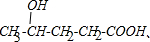 ���÷�ӦҲ���ڻ�ԭ��Ӧ����bc��ȷ��C��D�ķ�ӦΪ
���÷�ӦҲ���ڻ�ԭ��Ӧ����bc��ȷ��C��D�ķ�ӦΪ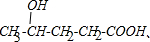 ����������������Ӧ����
����������������Ӧ����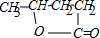 ���÷�ӦΪ������Ӧ��Ҳ����ȡ����Ӧ����d��ȷ��
���÷�ӦΪ������Ӧ��Ҳ����ȡ����Ӧ����d��ȷ��
�ʴ�Ϊ��bc��d��
��5��ΪCH3CH��Br��CH��Br��CH2COOH��������к��й�������ԭ�ӣ��ܹ����������Ƶ�ˮ��Һ�з���ȡ����Ӧ����Ӧ�Ļ�ѧ����ʽΪ�� ��
��
�ʴ�Ϊ�� ��
��
��6��F�Ľṹ��ʽΪCH3CH=CHCH2COOH��M��F��ͬϵ�����Է���������FС14����M�����к���1��̼̼˫����1���Ȼ����ܹ�����4��Cԭ�ӣ�����M���ܵĽṹ��ʽΪ��CH2=CHCH2COOH��CH3CH=CHCOOH��CH2=C��CH3��COOH��
�ʴ�Ϊ��CH2=CHCH2COOH��CH3CH=CHCOOH��CH2=C��CH3��COOH��
���� ���⿼���л��ƶϣ���Ŀ�Ѷ��еȣ����ݳ����л���ṹ�����ʼ���Ӧ������ȷ�ƶϸ��л���Ϊ���ؼ���ע������ͬ���칹��ĸ����дԭ������������ѧ���ķ���������������������������


 �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д� ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д� �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ԣ�H2SO4��H3PO4 | B�� | �ǽ����ԣ�Cl��Br | ||
| C�� | ���ԣ�NaOH��Mg��OH��2 | D�� | ���ȶ��ԣ�Na2CO3��NaHCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
�� ��
�� B��
B��
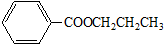
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
�� ��
��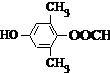 ��
��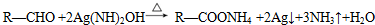 ��
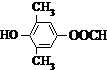
��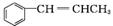 Ϊԭ���Ʊ�
Ϊԭ���Ʊ�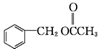 �ĺϳ�·������ͼ���£����ڷ����ڲ����л���Ľṹ��ʽ��
�ĺϳ�·������ͼ���£����ڷ����ڲ����л���Ľṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=5��NH4Cl��Һ�������Һ�У���ˮ�������c��H+����Ϊ10-9mol•L-1 | |
| B�� | �����£���pH=3�Ĵ����pH=11��NaOH��Һ�������Ϻ�pH��7 | |
| C�� | ��c��H+����c��OH-��=1��l012����Һ�У�Na+��I-��NO3-��SO42-�ܴ������� | |
| D�� | 0.1 mol•L-1 Na2CO3��Һ��0.1 mol•L-1 NaHSO4��Һ�������ϣ���Һ�У�c��Na+��+c��H+��=c��CO32-��+c��SO42-��+c��HCO3-��+c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
��| �縺�� | �۷е� | �ȶ��� | ���� |
| O��N | NH3��PH3 | Fe2+�� Fe3+ | H3PO4��HNO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪Ka��HCN����Ka��CH3COOH���������ʵ���Ũ����ͬʱ��CH3COOH��ˮ�����c��H+������HCN��ˮ�������c��H+�� | |
| B�� | ��C��ʯī��=C�����ʯ����H=+1.90 kJ•mol-1��֪�����ʯ��ʯī�ȶ� | |
| C�� | ��2.0 mLŨ�Ⱦ�Ϊ0.1 mol•L-1 ��KCl��KI�����Һ�еμ�1��2��0.01 mol•L-1 AgNO3 ��Һ���������ʻ�ɫ��˵��AgCl ��Ksp��AgI ��Ksp�� | |
| D�� | ��101 kPaʱ��2 g H2 ��ȫȼ������Һ̬ˮ���ų�285.8 kJ����������ȼ���ȵ��Ȼ�ѧ����ʽ��ʾΪ��2H2��g��+O2��g��=2H2O��l����H=-285.8 kJ•mol-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com