
分析 根据金属与酸发生反应的条件(在金属的活动性顺序表中排在H前面的金属能与酸发生反应,产生氢气,H后面的金属不能与酸反应)以及金属与盐溶液发生反应的条件(在金属的活动性顺序表中排在前面的金属能把它后面的金属从其盐溶液中置换出来)便可判断金属的活动性强弱.
解答 解:①把A、B、C、D四种金属分别浸入稀硫酸中,A、B产生气泡较剧烈,C、D产生气泡都很慢,所以A、B的活泼性强于C、D;
②把C、D两金属用导线连接后浸入稀硫酸中,气泡从C金属片析出,说明C极是氢离子放电,生成氢气,发生还原反应,所以C是正极,则D的活泼性强于C;
③把A、B两金属片用导线连接浸入稀硫酸组成原电池时,电流由A→B,说明A是正极,B是负极,所以B比A活泼;综上所述金属的活泼性是:B>A>D>C,故答案为:B>A>D>C.
点评 根据金属与酸发生反应的条件、以及金属与盐溶液发生反应的条件,可判断金属的活动性强弱,这一点要求学生要牢牢的掌握.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、NO3-、S2- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | K+、Fe2+、I-、SO42- | D. | Na+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;.
;.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
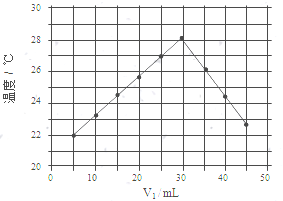 水不仅是包括人类在内所有生命生存的重要资源,也是化学反应中的重要物质:
水不仅是包括人类在内所有生命生存的重要资源,也是化学反应中的重要物质: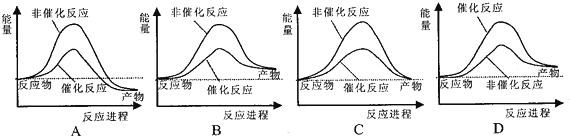
| 物质 | H-H | O=O | H-O |
| 键能/(kJ•mol-1) | 436 | 498 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CO2合成可降解塑料,实现碳的循环利用 | |
| B. | 提倡使用太阳能、潮汐能、风能等清洁能源,减少化石燃料的使用 | |
| C. | 提高煤炭和石油的产量,以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用,即减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL | B. | 250mL | C. | 200mL | D. | 100mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
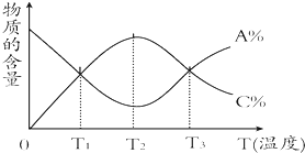
| A. | 该反应在T1、T3温度时达到化学平衡 | |
| B. | 该反应在T2温度时未达到化学平衡 | |
| C. | 升高温度,平衡会向正反应方向移动 | |
| D. | 该反应的正反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态氧、干冰、硫酸、烧碱、氯化钠 | B. | 碘酒、冰、盐酸、烧碱、食盐 | ||
| C. | 氢气、二氧化硫、硝酸、纯碱、硝酸钾 | D. | 铜、硫酸钠、醋酸、石灰水、氯化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol•L-1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol•L-1) | c1 | c2 | 0.4 |
| A. | 若升高温度,反应的平衡常数减小,则正反应为吸热反应 | |
| B. | 反应5 min内,v(PCl3)=0.08 mol•L-1•min-1 | |
| C. | 当容器中为1.2 mol Cl2时,可逆反应达到平衡状态 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com