
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 L 0.1 mol·L-1的氨水中有0.1NA个NH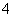
B.标准状况下,22.4 L盐酸含有NA个HCl分子
C.常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为0.5NA
D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.2NA
科目:高中化学 来源: 题型:
某高聚物的结构片断如下:
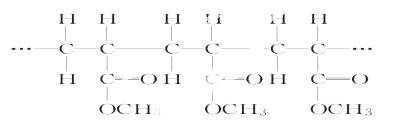
下列分析正确的是( )
A.它是缩聚反应的产物 B.其单体是CH2=CH2和HCOOCH3
C.其链节是CH3CH2COOCH3 D.其单体是CH2=CHCOOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A、B、C、D、E、F、G相互关系如图所示。5.2 g F能与100 mL 1 mol·L-1的NaOH溶液恰好完全中和,0.1 mol F还能与足量金属钠反应,在标准状况下放出2.24 L H2。D的分子式为C3H3O2Na,E的分子中含有羧基。
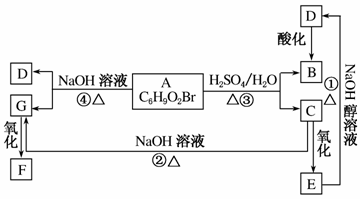
(1)写出下列物质的结构简式:G:________________;F:________________。
(2)化学反应类型:①________________;④________________。
(3)化学方程式:①__________________________;③__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.1 mol Na2O2固体中含有的O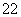 数为2NA
数为2NA
B.常温常压下,3.2 g CH4中含有的电子数为2NA
C.标准状况下,11.2 L CH3CH2OH中含有的分子数为0.5NA
D.100 mL 1 mol·L-1的CH3COOH溶液中含有的CH3COOH分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
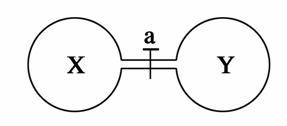
常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是( )
| 编号 | ① | ② | ③ | ④ |
| 气体X | HI | NH3 | H2 | NO |
| 气体Y | Cl2 | HCl | Cl2 | O2 |
A.②>③>①>④ B.③>①=④>②
C.③>①>④>② D.④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
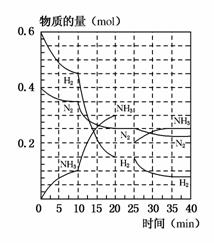
500 ℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示(10 min时达到第一次平衡),下列说法正确的是( )
A.反应开始到第一次平衡时,N2的平均反应速率为0.005 mol/(L·min)
B.从曲 线可以看出,反应进行到10 min至20 min时可能是使用了催化剂
线可以看出,反应进行到10 min至20 min时可能是使用了催化剂
C.从曲线可以看出,反应进行至25 min时,增加了0.1 mol 的氨气
D.在25 min时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
查看答案和解析>>
科目:高中化学 来源: 题型:
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)CaS(s)+4CO2(g)
ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能够自发进行的反应条件是________。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量的浓度c(B),则反应Ⅱ的Kp=________(用表达式表示)。
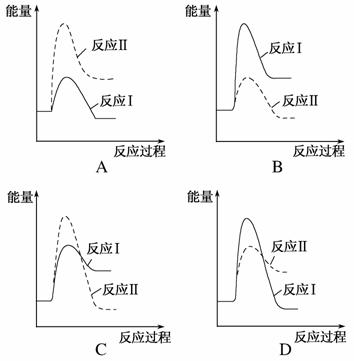
(3 )假设某温度下,反应Ⅰ的速率(v1)大于
)假设某温度下,反应Ⅰ的速率(v1)大于 反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是________。
反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是________。
(4)通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是____________________________________________________ ______________________________________________________________________________________
(5)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有________。
A.向该反应体系中投入石灰石
B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度
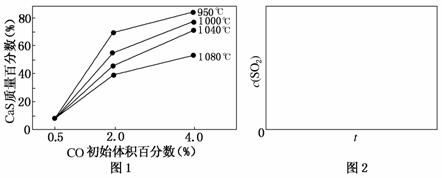
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列按纯净物、混合物、电解质和非电解质顺序排列的是 ( )
A.盐酸、空气、醋酸、干冰 B.冰醋酸、福尔马林、硫酸钠、乙醇
C.蛋白质、油脂、苛性钾、石灰石 D.胆矾、漂白粉、氯化钾、硫酸钡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com