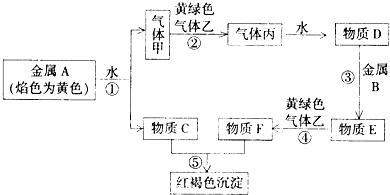
分析:(1)有效“减碳”的手段之一是节能,利用太阳光催化分解水制氢是最节能的,减少电能、天然气、热能的利用;
(2)化剂不影响反应热,但催化剂降低反应所需的活化能,以此来图画;
(3)①根据v=
计算出v(CH
3OH),然后根据速率之比等于化学计量数之比求出v(H
2);
②在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理性也不变;
③依据化学平衡移动原理结合反应特征防止判断选项;
④依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到,改变条件使K=1.
解答:
解:(1)A、消耗电能,不是最节能的方法,故A错误;
B、消耗热能,不是减碳的手段,故B错误;
C、利用太阳光催化分解水制氢是最节能的,故C正确;
D、天然气是非再生能源,且不是最节能的方法,故D错误;
故答案为:C;
(2)催化剂不影响反应热,但催化剂降低反应所需的活化能,如图所示催化剂对反应的影响为
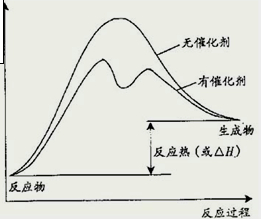
,
故答案为:

;
(3)①由图象可知:v(CH
3OH)=
=0.0357mol/(L?min),v(H
2)=3v(CH
3OH)=0.11mol/(L?min);
故答案为:0.11mol/(L?min);
②A.由图可知反应中CO
2与CH
3OH的物质的量浓度之比为1:1时,并未达到平衡状态,故A错误;
B.因气体的质量不变,容器的体积不变,则无论是否达到平衡状态,都存在混合气体的密度不随时间的变化而变化,不能判断是否达到平衡状态,故B错误;
C.无论是否达到平衡状态,都存在单位时间内每消耗3molH
2,同时生成1molH
2O,故C错误;
D.CO
2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确;
故选:D;
③CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)△H=-49.0kJ/mol,反应是气体体积减小的放热反应,能使
增大,说明平衡正向进行;
A.反应是吸热反应,升高温度,平衡逆向进行,
减小,故A不符合;
B.恒温恒容充入He(g),总压增大,分压不变,平衡不动,故
不变,故B不符合;
C.将H
2O(g)从体系中分离,平衡正向进行,
增大,故C符合;
D.恒温恒容再充入1mol CO
2和3mol H
2 ,相当于增大压强,平衡正向进行,
增大,故D符合;
故答案为:CD.
④依据化学平衡三段式列式计算,在某温度下体积为1L的恒容密闭容器中,充入 1molC0
2和3mol H
2,图象分析平衡使甲醇浓度为0.75mol/L,二氧化碳浓度为0.25mol/L,
CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L)0.25 0.75 0.75 0.75
平衡常数K=
=
;
改变条件使K=1,应使平衡逆向进行,分析选项改变条件
A、增大压强,平衡正向进行,平衡常数不变,故A不符合;
B、增大反应物浓度,平衡正向进行,平衡常数不变,故B不符合;
C、反应是放热反应,降低温度,平衡正向进行,平衡常数增大,故C不符合;
D、升高温度,平衡逆向进行,平衡常数减小,可以达到K=1,故D符合;
E、加入催化剂,改变反应速率不改变化学平衡,平衡不动,平衡常数不变,故E不符合;
故答案为:
;D.

 联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP 二氧化碳排放比2005年下降40%-45%.
联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP 二氧化碳排放比2005年下降40%-45%.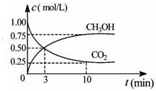
 ,
, ;
;

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案