

分析 (1)乙酸和乙醇的混合液体在加热时容易发生暴沸,可以加入碎瓷片防止暴沸;冷却水的流向为下进上出;
(2)乙酸乙酯在水中溶解度较大,应该用饱和碳酸钠溶液吸收乙酸乙酯;根据分液操作方法选择使用的仪器;
(3)①乙醇与乙酸均容易溶解于饱和碳酸钠溶液,若导管插入液面下,容易倒吸;
②酯类在碱性溶液中发生水解,据此判断即可;
(4)组成分子的各种基团都有自己特定的红外特征吸收峰,所以通过红外光谱可以判断有机物的基团种类.
解答 解:(1)给乙酸和乙醇的混合液体加热过程中容易发生暴沸现象,故小于加入碎瓷片防止暴沸;冷却水的流向为下进上出,这样冷却效果好,故答案为:防止暴沸;a;
(2)吸收乙酸乙酯应该选用饱和碳酸钠溶液,所以应该把C中水换成饱和碳酸钠溶液;分液操作用到的仪器有:分液漏斗、烧杯和玻璃棒,即:afg,
故答案为:C中水换成饱和碳酸钠溶液;afg;
(3)①乙醇与乙酸均容易溶解于饱和碳酸钠溶液,若导管插入液面下,容易倒吸,故不能利用D代替C,故答案为:否;导管插入碳酸钠溶液,易引起液体倒吸;
②酯类在碱性溶液中发生水解,即乙酸乙酯在氢氧化钠溶液中会水解生成乙酸钠和乙醇,使乙酸乙酯量减小,引起损耗,
故答案为:否;乙酸乙酯在氢氧化钠溶液中会水解生成乙酸钠和乙醇,使乙酸乙酯量减小;
(4)组成分子的各种基团都有自己特定的红外特征吸收峰,利用红外光谱对有机化合物分子进行测试并记录,可以清晰的记录出不同基团的吸收峰,所以可初步判断该有机物分子拥有的基团种类,故鉴定所得产物中是否含有醚类物质可以选用红外光谱法,故答案为:a.
点评 本题考查了乙酸乙酯的制备、常见仪器的构造及使用方法,题目难度中等,注意掌握乙酸乙酯的反应原理及制备方法,明确常见化学仪器的构造及正确的使用方法.


科目:高中化学 来源: 题型:选择题
| A. | 氯乙烯、聚乙烯、苯乙炔都是不饱和烃 | |
| B. | 苯能与溴水在一定条件下发生取代反应 | |
| C. | 减少化石燃料使用,有利于降低空气中PM2.5(直径2.5μm以下细颗粒物)的含量 | |
| D. | 乙烯、苯、甲苯都能使高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
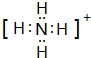 ,B-的化学式为OH-.
,B-的化学式为OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
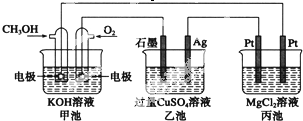
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
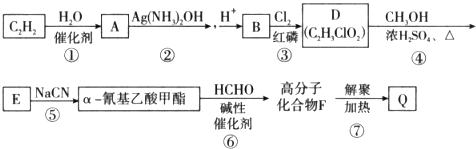
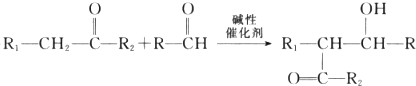
 不稳定,很快分子间脱水进行聚合,[R、R1和R2可表示氢原子、烃基、-OCH3、-CN(氰基)等基团]
不稳定,很快分子间脱水进行聚合,[R、R1和R2可表示氢原子、烃基、-OCH3、-CN(氰基)等基团] .
.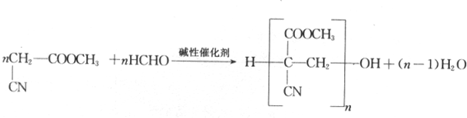 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
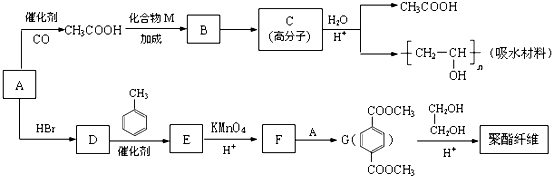
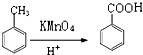
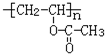 ,D→E的反应类型是取代反应.
,D→E的反应类型是取代反应.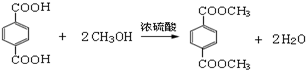 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C与12C60中碳原子化学性质相同 | B. | 14C与14N的质量数相同 | ||
| C. | 14C是12C60的同素异形体 | D. | 14C与12C、13C互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
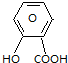 $\stackrel{NaHCO_{3}溶液}{→}$X$\stackrel{NaOH溶液}{→}$Y$\stackrel{CO_{2}}{→}$Z$\stackrel{HCl}{→}$M$→_{浓H_{2}SO_{4}△}^{CH_{3}OH酯化}$N
$\stackrel{NaHCO_{3}溶液}{→}$X$\stackrel{NaOH溶液}{→}$Y$\stackrel{CO_{2}}{→}$Z$\stackrel{HCl}{→}$M$→_{浓H_{2}SO_{4}△}^{CH_{3}OH酯化}$N ,Y
,Y ,Z
,Z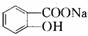 ,M
,M ,N
,N .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com