
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
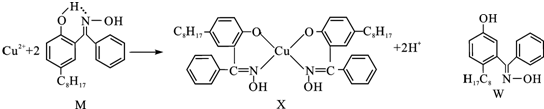
分析 (1)分子内氢键的存在,导致水溶性减小,据此解答即可;
(2)根据核外电子排布规律书写Cu原子的核外电子排布式,电子按能层高低进行失去,进而书写Cu2+的外围电子排布式;判断Sc3+、Zn2+离子的原子核外3d轨道上是否含有电子来判断是否有颜色.
解答 解:(1)由于M能形成分子内氢键,使溶解度减小,故答案为:M能形成分子内氢键,使溶解度减小;
(2)Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,故Cu2+的外围电子排布式为3d9,Zn2+离子的原子核外排布式为1s22s22p63s23p63d10,d轨道上有10个电子,故Zn2+ 无色,Sc3+离子的原子核外排布式为1s22s22p63s23p6,其d轨道上有0电子,处于全空,故没有颜色,故答案为:3d9;3d轨道上没有未成对电子(3d轨道上电子为全空或全满).
点评 本题考查较为综合,涉及多个方面的知识,题目难度较大,本题注意晶体类型以及对数据的分析和判断,学习中注重相关基础知识和解题方法的积累.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
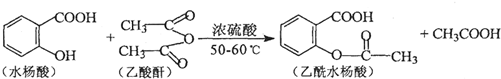
 .
.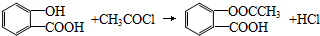 .
.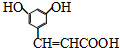 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为:O2+2H2O+4e═4OH- | |
| B. | 负极反应为:CH4+10OH--8e═CO32-+7H2O | |
| C. | 放电时溶液中的阳离子向负极移动 | |
| D. | 随放电的进行,溶液的pH值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
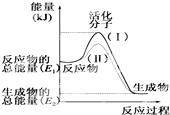 请认真观察如图,然后回答问题:
请认真观察如图,然后回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
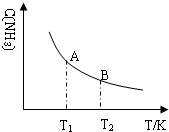
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①② | C. | ②④ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
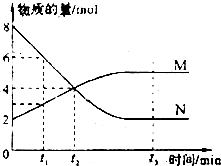 在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如下图,下 列表述中正确的是( )
在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如下图,下 列表述中正确的是( )| A. | t3时,正反应速率大于逆反应速率 | |
| B. | t2时,正逆反应速率相等,反应达到平衡状态I 已反应的 | |
| C. | 化学方程式为:2M=N | |
| D. | t1时,N的浓度是M浓度的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com