
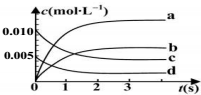
 在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
分析 (1)从图象分析,随反应时间的延长,各物质的浓度不再不变,且反应物没有完全反应,5s时反应达到平衡状态,NO物质的量变化了0.02mol-0.007mol=0.013mol,转化率=$\frac{消耗量}{起始量}$×100%;
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量;
根据△v=$\frac{\frac{△n}{V}}{△t}$计算一氧化氮的反应速率,再结合同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比计算氧气的反应速率;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:(1)从图象分析,随反应时间的延长,各物质的浓度不再不变,且反应物没有完全反应,所以反应为可逆反应,5s时反应达到平衡状态,NO物质的量变化了0.02mol-0.007mol=0.013mol,转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.013mol}{0.020mol}$×100%=65%,
故答案为:是; 65%;
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量,所以表示NO2的变化的曲线是b,
0~2s内v(NO)=$\frac{\frac{0.020mol-0.008mol}{2L}}{2min}$=0.0030mol/(L.min),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以氧气的反应速率为 0.0015mol/(L•s),
故答案为:b;0.0015mol/(L•s);
(3)A.反应速率之比等于化学方程式计量数之比,υ(NO2)=2υ(O2)是正反应速率之比,无法判断正逆反应速率是否相等,故A错误;
B.反应前后气体体积不同,压强不变说明正逆反应速率相等,各组分浓度不变,故B正确;
C.v逆(NO)=2v正(O2)时,说明NO正逆反应速率相等,反应达到平衡状态,故C正确;
D.恒容容器,反应物生成物都是气体质量不变,所以密度不变不一定平衡,故D错误;
故选BC,
故答案为:BC.
点评 本题考查了可逆反应的判断、反应速率的计算、影响反应速率及化学平衡状态的判断,注意压强、密度不变时平衡状态的判断为易错点,题目难度中等.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2直线形 | B. | CO2平面三角形 | C. | BCl3三角锥形 | D. | CH4正四面体形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂、蛋白质都能发生水解反应 | |
| B. | 蔗糖溶液中加入新制Cu(OH)2煮沸会析出砖红色沉淀 | |
| C. | 纤维素、淀粉都可用(C6H10O5)n表示,它们互为同分异构体 | |
| D. | 人体各种组织的蛋白质不断分解,最终生成二氧化碳和水,排出体外 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非自发反应在任何情况下都不会发生 | |
| B. | 室温下不能自发进行的反应,在高温下有可能自发进行 | |
| C. | 温度、压强一定时,吸热的熵增反应一定能够自发进行 | |
| D. | 固体的溶解过程与熵变无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡CH+H2O $→_{△}^{HgSO_{4}}$CH3CHO | |
| B. | C2H5Br+H2O $→_{△}^{NaOH}$ C2H5OH+HBr | |
| C. | CaC2+2H2O→Ca(OH)2+C2H2↑ | |
| D. | CH3COOCH3+H2O$→_{△}^{催化剂}$CH3COOH+CH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解含CuSO4和NaCl的溶液,在阴极可能析出气体,阳极一定析出气体 | |
| B. | 电解CuCl2溶液可得到铜和氯气,阴极区酸性减弱,阳极区pH不变 | |
| C. | 碱性锌锰干电池的负极反应为:Zn-2e-+4OH-═ZnO22-+2H2O | |
| D. | 原电池负极金属一定比正极金属的金属性活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠可能最多 | B. | 铝铁不可能一样多 | ||
| C. | 铝一定最多 | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com