
A.有AgCl沉淀析出  | B.无AgCl沉淀析出 |
| C.有沉淀析出,但不是AgCl | D.无法确定是否有沉淀析出 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a=b | B.c(H+)=c(OH-)=10-7mol·L-1 |
| C.混合液中Kw=c2(OH-) | D.c(H+)+c(B+)=c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
A.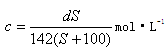 | B.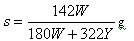 |
| C.100X=YS | D.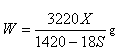 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu(OH)2>CuCO3>CuS | B.Cu(OH)2<CuCO3<CuS |
| C.CuS >Cu(OH)2>CuCO3 | D.CuS <Cu(OH)2<CuCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶度积小的沉淀可以转化为溶度积更小的沉淀 |
| B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生 |
| C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 |
| D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化银可溶于氨水 | B.银氨溶液中加入氯化钠溶液有白色沉淀 |
| C.银氨溶液中加入盐酸有白色沉淀 | D.银镜反应的残留液可用稀硝酸处理 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.9.0 | B.9.5 | C.8.5 | D.10.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.8×10-6mol/L | B.1.8×10-7mol/L | C.1.8×10-8mol/L | D.不存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com