
| ① | ② | ③ | ④ | |
| X | NaOH溶液 | KOH溶液 | O2 | FeCl3溶液 |
| Y | Al(OH)3 | SiO2 | N2 | Cu |
| Z | 稀硫酸 | 浓盐酸 | H2 | 浓硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
分析 ①Al(OH)3能与酸反应,又能与碱反应;
②二氧化硅是酸性氧化物只与碱反应,不与酸反应;
③氮气与氧气在放电条件下反应得到NO,氮气与氢气在高温高压、催化剂条件下合成氨气反应;
④Cu与浓硝酸反应生成硝酸铜、二氧化氮与水,与氯化铁溶液反应得到氯化铜、氯化亚铁.
解答 解:①氢氧化铝是两性氢氧化物,所以Al(OH)3能与酸反应,又能与碱反应,故①符合;
②二氧化硅是酸性氧化物只与碱反应,不与酸反应,所以二氧化硅与浓盐酸不反应,故②不符合;
③氮气与氧气在放电条件下反应得到NO,氮气与氢气在高温高压、催化剂条件下合成氨气反应,常温下氮气不能与氧气、氢气发生反应,故③不符合;
④常温下,Cu与浓硝酸反应生成硝酸铜、二氧化氮与水,与氯化铁溶液反应得到氯化铜、氯化亚铁,故④符合,
故选B.
点评 本题考查元素化合物性质,难度不大,侧重对基础知识的巩固,需要学生熟练掌握元素化合物性质.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子数为0.1NA 的N2 和NH3 混合气体,原子间含有的共用电子对数目为0.3NA | |
| B. | 2 mol SO2 和1 mol O2 在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| C. | 1.5 mol NO2 与足量水反应,转移的电子数为1.5NA | |
| D. | 常温条件下,分子数为NA 的CO、N2混合气体质量为28 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
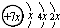 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
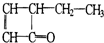 ,可表示为
,可表示为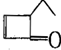 ,某有机物
,某有机物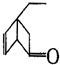 的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )
的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
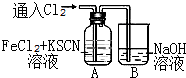 甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,发现A中溶液先呈红色后逐渐变为黄色.
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,发现A中溶液先呈红色后逐渐变为黄色.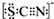 .则碳元素的化合价是+4
.则碳元素的化合价是+4查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色食品是不含任何化学物质的食品 | |
| B. | Na2O2与CO2反应,Na2O2是氧化剂、CO2是还原剂 | |
| C. | 向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀 | |
| D. | 称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液.则放出氢气的体积(同温同压下)不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0g甲醛和甲酸甲酯的混合物中含有的原子数为4NA | |
| B. | 氯碱工业中,当阴极产生标准状况下的气体22.4L时,电路中转移的电子数为2NA | |
| C. | 标准状况下,0.1mol苯中含有的σ键的数目为0.6NA | |
| D. | 配制200ml0.1mol/L的稀硫酸,需要98%的浓硫酸0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑥⑦ | B. | ①②③④⑥⑦ | C. | ①③⑤⑥⑦ | D. | 全有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com