
【题目】Ⅰ.苯是一种重要的化工原料,其产品在我们的生活中无处不在。
(1)一定条件下,利用如图所示装置可实现有机物苯(C6H6)到环己烷(C6H12)的转化。
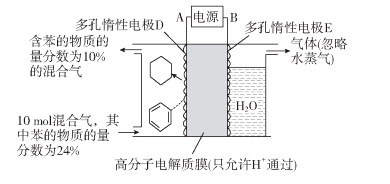
生成目标产物的电极反应式为__________;装置图右侧导出的气体是__________。
(2)已知苯和乙烯可以在催化剂存在的条件下发生加成反应。以苯和乙烯为原料可合成聚苯 乙烯,请设计合成路线(无机试剂及溶剂任选)。合成路线流程图示例如下:
H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
_________________________________________________________________________
II.丙烯是三大合成材料的基本原料,用于制丙烯腈、环氧丙烷、丙酮、甘油等。下图是以丙烯为原料合成甘油最重要的生产方法。
CH2=CHCH3 ![]() C3H5Cl
C3H5Cl ![]() C3H6OCl2
C3H6OCl2 ![]()
![]()
![]() 甘油
甘油
(3)①的反应类型是:____________
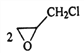
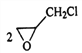
(4)产物C3H6OCl2有两种,选择一种写出反应③的化学方程式:____________
【答案】 C6H4+6H++6e-=C6H12 氧气 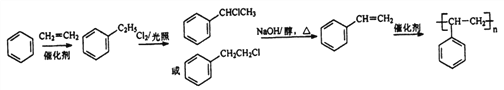 取代反应
取代反应 ![]() +Ba(OH)2
+Ba(OH)2 ![]()
 +BaCl2+2H2O
+BaCl2+2H2O
或![]() +Ba(OH)2
+Ba(OH)2 ![]()
 +BaCl2+2H2O
+BaCl2+2H2O
【解析】Ⅰ.(1)根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极。所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,阳极上氢氧根离子放电生成氧气,故答案为:C6H6+6H++6e-=C6H12;氧气;
(2)在催化剂作用下,苯和乙烯发生加成反应生成苯乙烷,在光照条件下,苯乙烷发生取代反应生成![]() ,在加热条件下,
,在加热条件下,![]() 和氢氧化钠的醇溶液发生消去反应生成苯乙烯,在催化剂条件下,苯乙烯发生加聚反应生成聚苯乙烯,所以其合成路线为:
和氢氧化钠的醇溶液发生消去反应生成苯乙烯,在催化剂条件下,苯乙烯发生加聚反应生成聚苯乙烯,所以其合成路线为: ,故答案为:
,故答案为: ;
;
II.CH2=CHCH3与氯气在500℃时发生取代反应生成CH2=CHCH2Cl,CH2=CHCH2Cl与HClO发生加成反应生成C3H6OCl2,为![]() 或
或![]() ,与氢氧化钡反应生成
,与氢氧化钡反应生成![]() ,再水解生成甘油。
,再水解生成甘油。
(3)根据上述分析,①为取代反应,故答案为:取代反应;
(4)产物C3H6OCl2有两种结构,分别为![]() 或
或![]() ,反应③的化学方程式为
,反应③的化学方程式为![]() +Ba(OH)2
+Ba(OH)2 ![]()
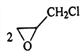 +BaCl2+2H2O或
+BaCl2+2H2O或![]() +Ba(OH)2
+Ba(OH)2 ![]()
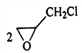 +BaCl2+2H2O,故答案为:
+BaCl2+2H2O,故答案为:![]() +Ba(OH)2
+Ba(OH)2 ![]()
 +BaCl2+2H2O或
+BaCl2+2H2O或![]() +Ba(OH)2
+Ba(OH)2 ![]()
 +BaCl2+2H2O。
+BaCl2+2H2O。


科目:高中化学 来源: 题型:
【题目】世界上绝大部分卤素都存在于海洋。海水呈微碱性,海水晒盐可以得到粗盐和卤水,对粗盐和卤水进一步加工可以得到氯气、溴以及其他一些重要的化工产品。
完成下列填空:
(1)工业上用电解饱和食盐水的方法获取氯气。写出阴极的电极反应式_______________,该反应为________(选填“氧化”、“还原”)反应。若转移5mol电子,生成氯气______L(标准状况下)。
(2)工业上从卤水获取溴,涉及到“氧化”、“提取”等步骤。“氧化”时先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率,原因是________________。在“提取”过程中,用空气把溴吹出,然后用碳酸钠溶液吸收,这时溴转化为Br-和BrO3-,同时有CO2生成,写出反应的化学方程式________________________________。
(3)用上述方法制得的液溴常溶有少量氯气,除去氯气的方法是_____________。
(4)足量氯气与铁反应生成氯化铁,足量碘与铁反应生成碘化亚铁。运用原子结构和元素周期律简要说明导致产物中铁元素价态不同的原因__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
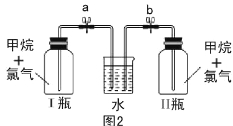
【题目】已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下两组实验方案:甲方案探究甲烷与氧化剂反应(如图1所示);乙方案探究甲烷与氯气反应的条件(如图2所示)。
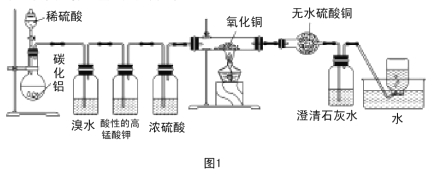
甲方案实验现象:溴水无颜色变化,无水硫酸铜变蓝色,澄清石灰水变浑浊。
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1∶4)的混合气体,I瓶放在光亮处,II瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b。
(1)碳化铝与稀硫酸反应的化学方程式为 。
(2)写出甲方案实验中硬质试管里可能发生的化学方程式 (实验测得消耗甲烷与氧化铜物质的量之比2∶7)。
(3)实验甲中浓硫酸的作用是 ,集气瓶中收集到的气体 (填“能”或“不能”)直接排入空气中?
(4)下列对甲方案实验中的有关现象与结论的叙述都正确的是( )
A.酸性高锰酸钾溶液不褪色,结论是通常条件下,甲烷不能与强氧化剂反应
B.硬质试管里黑色粉末变红色,说明氧化铜发生了氧化反应
C.硬质试管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳
D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应
(5)乙方案中烧杯里放入足量的水,打开弹簧夹a、b,一段时间后,观察到有水倒吸到I瓶中,但水并不能充满I瓶,请写出该实验现象所涉及的一个化学方程式 。除了上述现象外,该实验中还可能观察到的现象有 (填序号)。
A.I瓶中气体颜色变浅 B.I瓶中出现白雾
C.I瓶瓶内壁出现油状物质 D.II瓶中与I瓶现象相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、O、Na、Al、Si、S、Cl是常见的八种元素
请回答下列问题:
(1)Si在元素周期表中的位置为__ ;CO2的电子式是_______。
(2)上述元素中原子半径最大的是(写元素符号)______;最高价氧化物对应的水化物酸性最强的是__________(写化学式)。
(3)下列事实能说明O元素的非金属性比S元素的非金属性强的是__。
a.O2与H2S溶液反应,溶液变浑浊
b.O和S两元素的简单氢化物受热分解,前者的分解温度高
c.在氧化还原反应中,1molO2比1molS得电子多
(4)金刚石具有优良的耐磨,耐腐蚀性,应用广泛。一定条件下,Na还原CCl4可制备金刚石。反应结束冷却至室温后,回收其中的CCl4的实验操作名称为_____,除去粗产品中少里钠的试剂为_______。
(5)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图l),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。0~t1时,原电池的负极是Al片,此时,正极的电极反应式是_______,溶液中的H+向__极移动。t1时,原电池中电子流动方向发生改变,其原因是:___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林是一种治疗心脑血管疾病的药物,可由化合物E和M 在一定条件下合成得到(部分反应条件略)。

请回答下列问题:
(1)A的名称为________,A→B的反应类型为________。
(2)E的分子式是_______。D→E的反应中,加入的化合物X与新制Cu(OH)2反应产生红色沉淀的化学方程式为______________。
(3)G→J为取代反应,其另一产物分子中的官能团名称是________。1molG完全燃烧最少需要消耗______mo1O2。
(4)L的同分异构体Q 是芳香酸, ![]() ,T的核磁共振氢谱只有两组峰,Q的结构简式为______, R→S的化学方程式为__________。
,T的核磁共振氢谱只有两组峰,Q的结构简式为______, R→S的化学方程式为__________。
(5)上图中,能缩合成体型高分子化合物的酚类单体是________,写出能检验该物质存在的显色反应中所用的试剂及实验现象_______________________。
(6)已知:L→M的原理为:①
②
M的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已省略)。在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水。

实验现象:
试管①中加热一段时间后,可以看到试管内液体沸腾;
试管②中有少量液体凝结,闻到汽油的气味,往液体中滴加几滴高锰酸钾酸性溶液颜色褪去。根据实验现象回答下列问题:
(1) 装置A的作用是______________________________;
(2) 试管①中发生的主要反应有:
C17H36![]() C8H18+C9H18C8H18
C8H18+C9H18C8H18![]() C4H10+C4H8
C4H10+C4H8
丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为_________和________,这两种有机物混合后在一定条件下可聚合成高分子化合物,其反应类型属于______反应。其可能结构为______(填序号)

(3)写出试管③中反应的一个化学方程式_____________________________,该反应的类型为__________反应。
(4)试管②中的少量液体的组成是____________(填序号)
A.甲烷B.乙烯C.液态烷烃D.液态烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将气体X、Y放入密闭容器中发生反应生成Z,5min后达到平衡。其初始浓度和平衡浓度如下表:下列说法错误的是
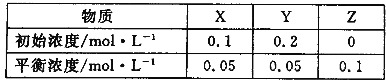
A.该反应可表示为 X+3Y![]() 2Z
2Z
B.反应达到平衡时,X的转化率为50%
C.前5min 以Y表示的平均反应速率为υ(Y)= 0.01 mol·L-1·min-1
D.增大压强使平衡向生成Z的方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com