

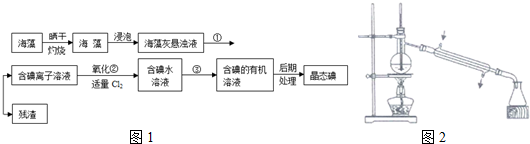
分析 (1)装置A中制备得到ClO2,所以A中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,反应结束后通入适量的空气,将ClO2吹入到装置B进行反应;
(2)装置B中反应生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平书写离子方程式;
装置I中通入SO2的不完全反应,在装置Ⅱ中被氧化生成硫酸,可以用利用硫酸钡是白色沉淀检验硫酸根;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制;
(4)由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl.
解答 解:(1)装置A中制备得到ClO2,所以A中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,反应的方程式为2NaClO3+Na2SO3+H2SO4=2 ClO2↑+2Na2SO4+H2O,反应结束后通入适量的空气,将ClO2吹入到装置B进行反应,
故答案为:2NaClO3+Na2SO3+H2SO4=2 ClO2↑+2Na2SO4+H2O;将ClO2吹入到装置B进行反应;
(2)装置B中反应生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,反应的离子方程式为:2OH-+2ClO2+H2O2=2ClO2-+2H2O+O2;装置A中通入SO2的不完全反应,在装置B中被氧化生成硫酸,溶液中可能存在SO42-,可以用氯化钡溶液检验SO42-,具体操作:取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-,
故答案为:2OH-+2ClO2+H2O2=2ClO2-+2H2O+O2;SO42-;取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
故答案为:趁热过滤;用38℃~60℃热水洗涤;低于60℃干燥;
(4)由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl,
故答案为:NaClO3和NaCl.
点评 本题考查亚氯酸钠制备实验的基本操作、亚氯酸钠的性质及中和滴定等知识,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,难度中等.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 室温下,测得某HA溶液中c(HA)=0.01mol•L-1 | |
| B. | 碳酸钠溶液中滴入0.1mol•L-1的HA溶液,产生大量无色气体 | |
| C. | 室温下测得某HA溶液的pH=a,用蒸馏水稀释100倍测得溶液pH=b,且b-a<2 | |
| D. | 室温下,测得0.1mol•L-1HA溶液的pH>1,证明HA是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如表:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如表:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com