
【题目】工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.图为离子交换膜法电解原理示意图:
请回答下列问题: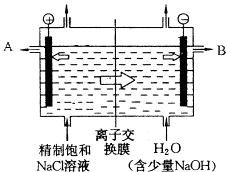
(1)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,这种阳离子交换膜,只允许溶液中的通过(填写下列微粒的编号).
①H2 , ②Cl2 , ③Cl﹣ , ④H+ , ⑤Na+ , ⑥OH﹣ .
(2)B极为电解槽的极,电极反应式为 .
(3)若用碱性氢氧燃料电池给予上述电解槽供电,燃料电池的正极反应式为:; 如果每小时能产生标准状况下的氯气V L,则每小时至少向燃料电池中输入氧气的物质的量(理论计算)mol.
(4)若将标准状况下13.44L的阳极气体通入热的氢氧化钠溶液中,反应中只有一种元素的化合价发生改变,得到了两种含氯化合物,其中还原产物与氧化产物物质的量之比为5:1,写出该反应的离子方程式
【答案】
(1)④⑤
(2)阴;2H++2e﹣═H2↑
(3)O2+4e﹣+2H2O═4OH﹣;![]()
(4)3Cl2+6OH﹣ ![]() 5Cl﹣+ClO3﹣+3H2O
5Cl﹣+ClO3﹣+3H2O
【解析】解:(1)阳离子交换膜只允许阳离子钠离子通过,而阴离子氢氧根和氯离子均不能通过,
所以答案是:④⑤;
(2.)电解池中和电源的正极相连的是电解池的阳极,所以A极为电解槽的阳极,氯离子发生失电子的氧化反应,即2Cl﹣﹣2e﹣═Cl2↑,B为电解池的阴极,电极反应为:2 H++2e﹣═H2↑,
所以答案是:阴;2 H++2e﹣═H2↑;
(3.)燃料电池中氧气得到电子在碱性溶液中生成氢氧根离子,电极反应为:O2+4e﹣+2 H2O═4 OH﹣ , 如果每小时能产生标准状况下的氯气V L,依据电子守恒和电极反应计算2Cl﹣﹣2e﹣═Cl2↑,O2+4e﹣+2 H2O═4 OH﹣ , 电子守恒得到O2~2Cl2 , 则每小时至少向燃料电池中输入氧气的物质的量= ![]() mol,
mol,
所以答案是:O2+4e﹣+2 H2O═4 OH﹣; ![]() ;
;
(4.)氯气和热的氢氧化钠溶液反应生成氯化钠、氯酸钠和水,反应中Cl元素的化合价由0价升高到+5价,还原产物与氧化产物物质的量之比为5:1,所以方程式为:3Cl2+6OH﹣ ![]() 5Cl﹣+ClO3﹣+3H2O,
5Cl﹣+ClO3﹣+3H2O,
所以答案是:3Cl2+6OH﹣ ![]() 5Cl﹣+ClO3﹣+3H2O.
5Cl﹣+ClO3﹣+3H2O.


科目:高中化学 来源: 题型:
【题目】烃A是一种植物生长的调节剂,分子式为C2H4 , A进行下图1所示的转化可制得有果香味的液体E(C4H8O2),回答下列问题: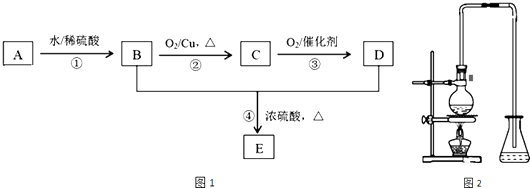
(1)A的结构简式为 , B中所含官能团的名称为 .
(2)①④反应的类型分别是、 .
(3)反应②的化学方程式为
(4)E的名称为 . 实验室由反应④制备E的装置如图2,烧杯中加入碎瓷片的作用是 , 长导管的作用是导气和 , 锥形瓶中盛放的液体是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧的反应热可通过以下两个途径来利用:A.利用煤在充足的空气中直接燃烧产生的反应热;B.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的热化学方程式为:
A.C(s)+O2(g)═CO2(g)△H=E1①
B.C(s)+H2O(g)═H2(g)+CO(g)△H=E2②
H2(g)+ ![]() O2(g)═H2O(g)△H=E3③
O2(g)═H2O(g)△H=E3③
CO(g)+ ![]() O2(g)═CO2(g)△H=E4④
O2(g)═CO2(g)△H=E4④
完成下列问题:
(1)上述四个反应中属于吸热反应的有 . (填序号)
(2)等量的煤分别通过以上两条不同的途径产生的热量(理论上)关系正确的是 .
A.a>b
B.a=b
C.a<b
(3)根据上述两个途径的关系,写出E4的数学表达式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,由水电离生成的c(H+)为1.0×10-12mol·L-1下列说法正确的是( )
A. 一定是酸溶液 B. 一定是碱溶液
C. 一定是显碱性的溶液 D. 可能是酸溶液,也可能是碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用,如回收利用电解精炼铜的阳极泥中含有的银、铂、金等贵重金属。提炼阳极泥的方法有多种,湿法提炼是其中重要的一种,其主要生产流程如下:
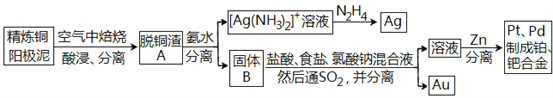
请回答下列问题:
(1)各步生产流程中都涉及了同一种分离方法,该方法需要的玻璃仪器有玻璃棒和_______。
(2)脱铜渣A中含有AgCl,它溶于浓氨水的离子方程式为________________。
(3)已知N2H4被银氨溶液氧化的产物是氮气,则每生成1molAg,需要消耗_______g N2H4。
(4)固体B中单质Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4;在NaAuCl4中Au元素的化合价为______,该反应的离子方程式为____________________。
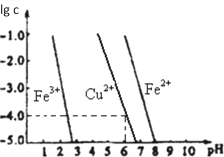
(5)阳极泥中的铜可以用FeC13溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合如图分析:(其中的纵坐标代表金属阳离子浓度的对数)
①要从浸出液中提纯铜,最好先加入酸化的双氧水,目的是_______________,然后加入适量的CuO调节pH=3.7,除去______离子;
②从图中数据计算可得Cu(OH)2的Ksp约为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液.下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )
A.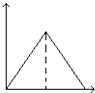
B.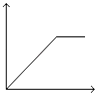
C.
D.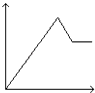
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水制取氯气、烧碱、溴及镁等工艺示意图如下:
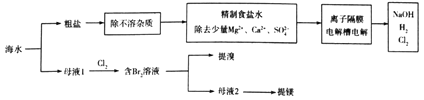
下列说法正确的是
A. “精制食盐水”时药品使用顺序为Na2CO3(aq)、NaOH(aq)、BaCl2(aq)及盐酸
B. 使用离子隔膜电解槽电解饱和食盐水时,其中的“隔膜”是“阳离子交换膜”
C. 工业上“母液1”氧化得到“含Br2溶液”后可直接用CCl4萃取,然后蒸馏得粗溴
D. “母液2”需经过加石灰乳生成沉定Mg(OH)2、过滤、盐酸溶解,然后直接电解得到镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com