
分析 (1)反应前后气体体积不变,恒温恒容下,往相同容器中加入2molX、6molY,X、Y的起始物质的量之比为1:2,与原平衡相同,与原平衡为等效平衡,平衡时同种反应物转化率相等;
(2)改变起始投料量,平衡后Z在反应混合气中的体积分数不变,两平衡等效,反应为前后气体体积不变的反应,按化学计量数转化到左边满足投料比相等即可,即满足n(X):n(Y)=1:3.
解答 解:(1)反应前后气体体积不变,恒温恒容下,往相同容器中加入2molX、6molY,X、Y的起始物质的量之比为1:2,与原平衡相同,与原平衡为等效平衡,平衡时同种反应物转化率不变,故生成Z 为amol×$\frac{2mol}{1mol}$=2amol,故答案为:2a mol;
(2)改变起始投料量,平衡后Z在反应混合气中的体积分数不变,两平衡等效,反应为前后气体体积不变的反应,按化学计量数转化到左边满足投料比相等即可,即满足n(X):n(Y)=1:3,则[2+$\frac{1}{3}$n(Z)]:[8+$\frac{2}{3}$n(Z)]=1:3,解得n(Z)=6,故答案为:6 mol.
点评 本题考查化学平衡计算,涉及等效平衡,关键是理解等效平衡规律:1、恒温恒容,反应前后气体体积不等,按化学计量数转化到一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化到一边,对应物质满足等比,2:恒温恒压,按化学计量数转化到一边,对应物质满足等比.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.56L丙烷中含有共价键的数目为2.5NA | |
| B. | 常温常压下,6.4g氧气和臭氧的混合气体中含有的原子总数为0.4NA | |
| C. | 5.6g铁与一定量浓硫酸恰好反应,转移的电子数目可能为0.2NA | |
| D. | 常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验目的 | 主要玻璃仪器 | 试剂 |
| A | 分离乙醇和乙酸混合物 | 蒸馏烧瓶、冷凝管、酒精灯、温度计、锥形瓶 | 乙醇和乙酸混合物 |
| B | 鉴别NH4Cl中的阳离子 | 试管、酒精灯 | NH4Cl、红色石蕊试纸、蒸馏水 |
| C | 实验室制取CO2 | 试管、带导管的橡皮塞 | 大理石、稀H2SO4 |
| D | 测定FeSO4溶液浓度 | 滴定管、锥形瓶、烧杯 | FeSO4溶液、0.1000mol•L-1KMnO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
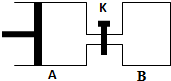 如图所示,容器A左侧是可平行移动的活塞.向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL.在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)?Z(g)+2W(g),达到平衡时V(A)=1.2aL.试回答:
如图所示,容器A左侧是可平行移动的活塞.向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL.在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)?Z(g)+2W(g),达到平衡时V(A)=1.2aL.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
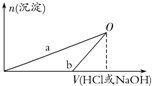 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.| A. | b曲线表示的是向X溶液中加入NaOH溶液 | |
| B. | 在O点时两方案中所得溶液浓度相等 | |
| C. | 方案②中对应的O点HCl恰好反应完 | |
| D. | X溶液显酸性,Y溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1>2c2 | B. | c2=2c1 | C. | c2<c1<2c2 | D. | c1=2c2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com