
| A. | 煤的干馏 | B. | 石油的分馏 | C. | 石油的裂化 | D. | 铝热反应 |
分析 A、煤的干馏是将煤隔绝空气加强热使煤分解的过程;
B、石油的分馏是根据石油组分的沸点的不同将石油中的组分分离的过程;
C、石油的裂化是将重油中的较长的碳链断裂以获得轻质油的过程;
D、铝热反应是铝与某些金属氧化物之间发生的置换反应.
解答 解:A、煤的干馏是将煤隔绝空气加强热使煤分解从而得到煤焦油、焦炭、焦炉煤气等产品的过程,是化学变化,故A不选;
B、石油的分馏是根据石油组分的沸点的不同,通过加热的方法获得馏分的过程,无新物质生成,是物理变化,故B选;
C、石油的裂化是将重油中的较长的碳链断裂以获得轻质油的过程,有新物质生成,是化学变化,故C不选;
D、铝热反应是铝与某些金属氧化物反应生成氧化铝和金属单质的过程,有新物质生成,是化学变化,故C不选.
故选B.
点评 本题考查了物理变化和化学变化的区别,应注意的是掌握各种变化的实质,难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:填空题
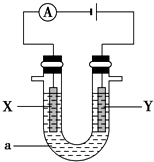
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
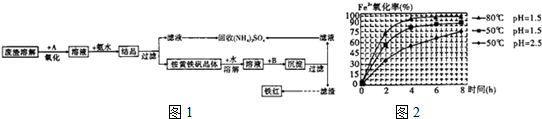 -
-查看答案和解析>>
科目:高中化学 来源: 题型:解答题
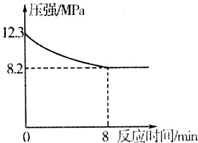 研究碳及其化合物的性质对于科研、生产生活具有重要意义.
研究碳及其化合物的性质对于科研、生产生活具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来 | |
| B. | 卤族元素从C1到I,最高价氧化物对应水化物的酸性减弱 | |
| C. | 卤族元素从F到I,HX水溶液酸性增强 | |
| D. | 卤素单质从F2到I2颜色加深,熔沸点升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4溶液浓度由大到小的顺序号:③>②>① | |
| B. | 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 若难溶电解质溶解度:A(OH)m大于B(OH)n,则Ksp也一定是前者大 | |
| D. | pH=4浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(104-10-10)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子半径大小呈周期性变化 | |
| B. | 元素原子最外层电子排布呈周期性变化 | |
| C. | 元素原子量依次递增 | |
| D. | 元素的最高正化合价呈周期性变化同温同压下 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com