
【题目】世界水产养殖协会介绍了一种利用电化学原理净化鱼池中水质的方法,其原理如图所示,电极C1、C2为惰性电极,下列说法正确的是( )
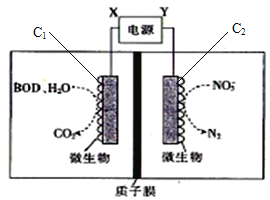
A. C1极上发生还原反应
B. Y为电源的负极
C. 若有1molNO3-被还原,则有1molH+通过质子膜迁移至阴极区
D. 若有机物为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极流出20mole-
【答案】B
【解析】
从装置图中可知,X电极连接的电极上发生反应是在微生物作用下有机物(如C6H12O6等)被氧化为CO2,发生氧化反应;Y电极连接电极上,微生物作用下,硝酸根离子被还原为氮气,氮元素化合价降低,发生还原反应,为电解池的阴极,则X为正极,Y为负极,结合电极反应和电子守恒计算,质子膜允许氢离子通过,据此分析判断。
X电极连接的电极上发生反应是微生物作用下有机物转化成CO2,发生氧化反应;Y电极连接电极上,微生物作用下,NO3-离子转化成氮气,氮元素化合价降低,发生还原反应,为电解池的阴极,则X为正极,Y为负极。
A.X为正极,C1为阳极,发生氧化反应,A错误;
B.根据上述分析分析可知:电源中Y为负极,X为正极,B正确;
C.若有1molNO3-被还原,根据阴极电极反应式2NO3-+10e-+12H+=N2↑+6H2O可知,电子转移5mol,则有5molH+通过质子膜迁移至阴板区,C错误;
D.1mol葡萄糖被完全氧化时,碳元素化合价0价变化为+4价,理论上电极上流出4×6mol=24mol e-,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】根据下表中的信息判断,下列说法错误的是

A. 第①组反应的氧化产物为O2
B. 第②组反应中C12与FeBr2的物质的量之比小于或等于1:2
C. 第③组反应中生成3mol C12,转移6mol电子
D. 氧化性由强到弱的顺序为C1O3- >C12>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H2AsO4和单质硫,写出发生反应的化学方程式 _____________________________________________;该反应需要在加压下进行,原因是 _______________________________________
(3)已知:As(s)+3/2H2(g)+2O2(g)=H3AsO4 (s) △H1
H2(g)+1/2O2(g)=H2O(l) △H2
2As(s)+5/2O2(g)=As2O5(s) △H3
则反应As2O5(s)+3H2O(l)=2H3AsO4 (s)的△H= ________________________
(4)298K时,将20mL 3xmol·L-1Na3AsO3、20mL 3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)与反应时间(t)的关系如图所示.
AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)与反应时间(t)的关系如图所示.
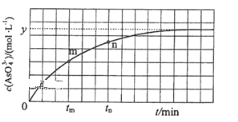
①下列可判断反应达到平衡的是 ______ (填标号).
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.c(AsO43-)/c(AsO33-)不再变化 d.c(I-)=ymol·L-1
②tm时,v正______v逆 ( 填“大于”“小于”或“等于”)
③tm时,v逆 ______tn时v逆(填“大于”“小于”或“等于”),理由是 ____________________
④若平衡时溶液pH=14,则该反应的平衡常数K为 ______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应aA(g)+bB(g)![]() cC(g)△H="Q" 在密闭容器中进行,在不同温度(T1和T2)及压强(P1和P2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )
cC(g)△H="Q" 在密闭容器中进行,在不同温度(T1和T2)及压强(P1和P2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )
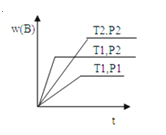
A. T1<T2,P1<P2,a+b>c,Q<0
B. T1>T2,P1<P2,a+b<c,Q>0
C. T1<T2,P1>P2,a+b<c,Q>0
D. T1<T2,P1>P2,a+b>c,Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香蕉果实成熟过程中由于储存的物质变为可溶性糖从而使果实甜度增加。某兴趣小组对此生理变化进行了初步探究:取未成熟香蕉果实若干放在适宜条件下让其自然成熟,每天定时取10 g果肉研磨配制成100 mL待测样液平分为A、B两份,分别用碘液和斐林试剂检测,记录颜色深浅的变化。
(1)样液A用碘液检测的目的是__________________;样液B用斐林试剂检测的目的是___________。
(2)斐林试剂使用时需甲、乙液等量混合均匀后再注入,并____________观察颜色变化。
(3)根据预期结果在坐标图中画出两种颜色的变化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2molA和1molB,发生下列反应:2A(g)+B(g)![]() 2C(g) △H< 0,达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图。下列对t1时刻改变条件的推测中正确的是
2C(g) △H< 0,达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图。下列对t1时刻改变条件的推测中正确的是

A、保持压强不变,升高反应温度
B、保持温度不变,增大容器体积
C、保持温度和容器体积不变,充入1molC(g)
D、保持温度和压强不变,充入1molC(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4H2O)是一种强还原性的碱性液体,是一种用途广泛的化工原料,实验室用如图装置制备(部分装置省略)。回答下列问题:
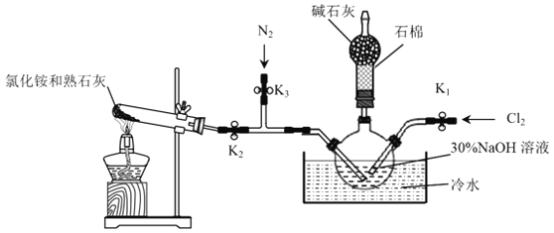
(1)步骤1关闭K2、K3,打开K1,制备NaClO;步骤2关闭______,打开_______,通入N2一段时间;关闭K3,打开K2,通入NH3,制备N2H4H2O。
(2)盛放碱石灰的仪器的名称为____________,碱石灰的作用_________________。
(3)步骤2中通入N2一段时间的原因是______________________。
(4)本装置中制备氨气的化学方程式是____________________________。
(5)NH3与NaClO反应生成N2H4H2O的化学方程式为______________________。
(6)已知:N2H4H2O+2I2=N2↑+4HI+H2O,实验室用碘标准溶液测定N2H4H2O粗产品的纯度。若称取N2H4H2O粗产品(其它杂质不与I2反应)2.000g,加水配成250.00mL溶液,移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液,用0.3000molL-1的碘标准溶液进行滴定,碘标准溶液盛放在______(填“酸式”或“碱式”)滴定管中。达到终点的现象是___________。实验测得消耗碘标准溶液的平均体积为20.00mL,则粗产品中水合肼的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“ ZEBRA”绿色电池是新型电动汽车的理想电源,结构如图所示:隔开两极的陶瓷管作钠离子导体。下列关于该电池的叙述错误的是

A. 放电时,Na+、Al3+均向负极移动
B. 放电时,Na元素被氧化
C. 充电时的阳极反应为:Ni+2C1--2e—=NiCl2
D. 该电池具有可快充、高比功率、放电持久等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类,如下所示:
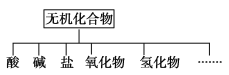
(1)上面所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥处。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②______ | ③______ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(3)写出实验室由⑩制备O2的化学方程式___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com