
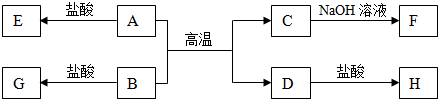
 .
.分析 A、D为单质,其余均为化合物,A、D是地壳中含量最多的两种金属元素的单质,分别为Al、Fe中的一种,A与B反应得到C与D,则A为Al、D为Fe,B与盐酸反应得到G,G遇KSCN溶液呈血红色,则G为FeCl3,B为Fe2O3,C为Al2O3,C与氢氧化钠反应得到F为NaAlO2,Fe与盐酸反应得到H为FeCl2,Al与盐酸反应得到E为AlCl3,据此解答.
解答 解:A、D为单质,其余均为化合物,A、D是地壳中含量最多的两种金属元素的单质,分别为Al、Fe中的一种,A与B反应得到C与D,则A为Al、D为Fe,B与盐酸反应得到G,G遇KSCN溶液呈血红色,则G为FeCl3,B为Fe2O3,C为Al2O3,C与氢氧化钠反应得到F为NaAlO2,Fe与盐酸反应得到H为FeCl2,Al与盐酸反应得到E为AlCl3.
(1)C的化学式为Al2O3,A为Al,原子结构示意图为 ,故答案为:Al2O3;
,故答案为:Al2O3; ;
;
(2)D到H的离子方程式为:Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(3)向G溶液中加入D物质的离子方程式:2Fe3++Fe═3Fe2+,故答案为:2Fe3++Fe═3Fe2+;
(4)工业上由C制取A的化学方程式:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,故答案为:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;
(5)由AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,可知向1mol AlCl3的溶液中加入4 mol NaOH也可全部转化为NaAlO2溶液,故答案为:4;
(6)A与B生成C与D是铝热反应,该反应在工业上可以进行焊接钢轨,故答案为:焊接钢轨.
点评 本题考查无机物的推断,涉及Fe、Al元素化合物性质与转化,需要学生熟练掌握元素化合物知识,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -317.3kJ/mol | B. | +317.3 kJ/mol | C. | -379.3kJ/mol | D. | -332.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适量摄入油脂,有助于人体吸收多种脂溶性维生素和胡萝卜素 | |
| B. | 利用油脂在碱性条件下的水解,可以生产甘油和肥皂 | |
| C. | 植物油通过氢化可以制造植物奶油(人造奶油) | |
| D. | 脂肪是有机体组织里储存能量的重要物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞呈红色的溶液:Na+、NH4+、Al3+、NO3- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1mol•L-1的溶液:Na+、K+、CO32-、ClO- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | 由水电离产生的c(OH-)=1×10-14mol•L-1溶液:K+、Na+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
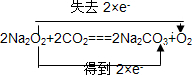 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
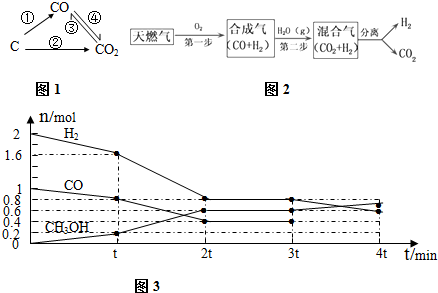
| 容器编号 | c(CO)/mol.L-1 | c(O2)/mol.L-1 | (CO2)/mol.L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
查看答案和解析>>
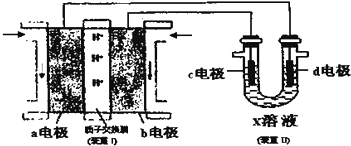
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O+H2O=2NaOH | B. | Zn+H2SO4=ZnSO4+H2↑ | ||
| C. | 2Na+Cl2=2NaCl | D. | Cl2+2KI=2KCl+I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com