

分析 根据常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红,可知C为O元素,D为Na元素,B的最外层电子数比C的最外层电子数少1个,则B的最外层电子数为5,且相邻,应为N元素,C与E同主族,E应为S元素,A与B相邻,A与C的最外层电子数之比2:3,则A的最外层电子数为4,应为C元素,F元素的原子在周期表中半径最小,F应为H元素,据此答题.
解答 解:根据常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红,可知C为O元素,D为Na元素,B的最外层电子数比C的最外层电子数少1个,则B的最外层电子数为5,且相邻,应为N元素,C与E同主族,E应为S元素,A与B相邻,A与C的最外层电子数之比2:3,则A的最外层电子数为4,应为C元素,F元素的原子在周期表中半径最小,F应为H元素,
(1)化合物AE2为CS2,其结构式为S=C=S,故答案为:S=C=S;
(2)化合物D2C2为Na2O2,Na2O2的电子式为 ,故答案为:
,故答案为: ;
;
(3)在容积不变的密闭容器中进行如下反应:3H2(g)+N2(g)?2NH3(g),若将平衡体系中各物质的浓度都增加到原来的2倍,即相当于将体积减小为原来的一半,根据勒夏特列原理可知,平衡向正反应方向移动,反应物的转化率增大,氢气的质量分数减小,压强增大,正逆反应速率都增大,故选AD.
点评 本题主要考查了电子式、结构式、化学平衡的移动等知识点,中等难度,解题的关键在于根据元素的性质确定元素种类,第(3)小问时注意化学平衡移动原理的灵活运用.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在强酸性溶液中:NH4+、Ca2+、NO3-、HCO3- | |
| B. | 强碱性溶液中:NH4+、Al3+、HCO3-、NO3- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、CO32- | |
| D. | 在无色溶液中:K+、H+、Cl-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )| A. | 1.0 mol/L,20 mL | B. | 0.5 mol/L,40 mL | C. | 0.5 mol/L,80 mL | D. | 1.0 mol/L,80 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.实验室常用的盐酸是密度1.20g•cm-3、质量分数36.5%.
Ⅰ.实验室常用的盐酸是密度1.20g•cm-3、质量分数36.5%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
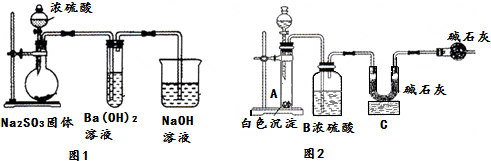
| 实验步骤 | 预期现象与结论 |
| 步骤1:用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液 | 白色沉淀不溶解,溶液呈红色. |
| 步骤2:往上述试管中滴加足量稀盐酸,充分振荡. | 若沉淀部分溶解,则含有②. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 化学键 | H-H | C-O | C$\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com