
某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是________。
A.冷水 B.沸水
C.NaOH浓溶液 D.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学方程式:____________________________。
(3)怎样用最简捷的方法检验制得的物质是胶体?__________________________ _________________________________________________________________________。
(4)取少量制得的胶体加入试管中,加入(NH4)2SO4溶液,现象是____________________,这种现象称为胶体的______________________。
(5)氢氧化铁胶体稳定存在的主要原因是________。
A.胶体微粒直径小于1 nm B.胶体微粒带正电荷
C.胶体微粒做布朗运动 D.胶体微粒能透过滤纸
(6)Fe(OH)3胶体区别于FeCl3溶液的最本质特征是________。
A.Fe(OH)3胶体微粒的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔现象
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
解析: (1)FeCl3在冷水中反应程度小,不能形成Fe(OH)3胶体;FeCl3与NaOH浓溶液反应生成Fe(OH)3沉淀。
(2)书写方程式时不能写成“Fe(OH)3↓”的形式。
(3)丁达尔现象是区别胶体与溶液的最简捷的方法。
(4)Fe(OH)3胶粒所带正电荷被SO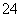 所带负电荷中和,产生红褐色沉淀。
所带负电荷中和,产生红褐色沉淀。
(5)Fe(OH)3胶体稳定存在的主要原因是胶体微粒带正电荷,互相排斥不易形成沉淀;布朗运动是胶体稳定存在的次要原因。
答案: (1)B (2)FeCl3+3H2O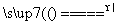 Fe(OH)3(胶体)+3HCl (3)利用丁达尔现象:让一束光线通过制得的物质,从侧面观察到一条光亮的“通路”,说明制得的物质是胶体 (4)产生红褐色沉淀 聚沉 (5)B (6)A
Fe(OH)3(胶体)+3HCl (3)利用丁达尔现象:让一束光线通过制得的物质,从侧面观察到一条光亮的“通路”,说明制得的物质是胶体 (4)产生红褐色沉淀 聚沉 (5)B (6)A


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
化学反应原理在科研和生产中有广泛应用。
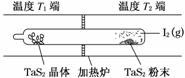
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0 (Ⅰ)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”、“<”或“=”)。上述反应体系中循环使用的物质是________。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为________________________________________________________________________。
(4)25℃时,H2SO3HSO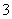 +H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中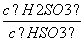 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物在氧气中充分燃烧,生成的水蒸气和二氧化碳的物质的量之比为1∶1,由此可以得出的结论是
( )
A.该有机物中C、H、O的原子个数比为1∶2∶3
B.分子中C、H的原子个数比为1∶2
C.有机物中必定含氧
D.有机物中必定不含氧
查看答案和解析>>
科目:高中化学 来源: 题型:
电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下图装置是用燃烧法确定有机物分子式的常用装置。
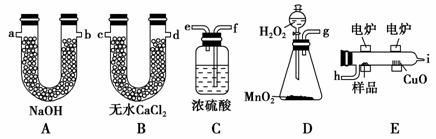
(1)产生的氧气按从左到右方向流动,所选装置各导管的连接顺序是________________________________________________________________;
(2)C装置中浓硫酸的作用是__________________________________________
______________________________;
(3)D装置中MnO2的作用是__________________________________________
_____________________________;
(4)燃烧管中CuO的作用是___________________________________________
____________________________;
(5)若准确称取0.90 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32 g,B管质量增加0.54 g,则该有机物的实验式为________;
(6)要确定该有机物的分子式,还要知道______________________________
_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将某溶液逐滴加入到氢氧化铁胶体中,开始产生沉淀,后又溶解的是( )
A.2 mol·L-1的氢氧化钠溶液 B.2 mol·L-1的硫酸溶液
C.2 mol·L-1的硫酸镁溶液 D.2 mol·L-1的乙醇溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
物质A在水中发生电离,其电离方程式为A===X2++2Y-,则下列判断错误的是(双选)( )
A.A可以是盐类 B.A可以是酸类
C.A可以是碱类 D.A可以是酸、碱或盐
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子反应方程式为( )
A.NH4HCO3溶于过量的浓KOH溶液中:NH4++ HCO3-+2OH-= CO32-+ NH3↑+2 H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:
2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
C.向FeBr2溶液中通入少量氯气:2Fe2++4Br-+3Cl2=2 Fe3++2 Br2+6 Cl-
D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=______ ;ΔH 0(选填“>”、“<”或“=”)。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,若测得反应初始至6 S内A的平均反应速率v(A)=0.003 mol · L-1· S-1,则6 S时c(A)=______ mol·L-1;C的物质的量为______ mol 。
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为______;如果这时向该密闭容器中再充入1 mol氩气,则平衡时A的转化率_ (选填“增大”、“减小”、“不变”)。
(4)判断该反应是否达到平衡的依据为______(填正确选项的字母)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(5)1200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为______ 。
A(g)+B(g)的平衡常数的值为______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的两个反应所属反应类型相同的是
( )
A.光照甲烷和氯气的混合气体,混合气体颜色变浅;乙烯能使溴水褪色
B.乙烷在氧气中燃烧;乙烯在氧气中燃烧
C.乙烯能使溴水褪色;乙烯能使酸性高锰酸钾溶液褪色
D.工业上由乙烯和水反应生成乙醇;乙烯能使酸性高锰酸钾溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com