
| A.所含四种元素的原子半径由小到大的顺序为:H<O<N<C |
| B.同周期的三种元素的得电子能力由大到小的顺序为: O>N>C |
| C.除去NaCl固体中混有少量的NH4HCO3固体可以采用加热的方法 |
D.其与足量氢氧化钠溶液共热的离子方程式为:NH4++OHˉ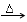 NH3↑+H2O NH3↑+H2O |
 NH3↑+H2O+CO2↑。不会有残留的固体杂质。因此可以采用加热的方法除去NaCl固体中混有少量的NH4HCO3杂质。正确。D.NaOH与NH4HCO3电离产生的阴离子、阳离子均发生反应。故其与足量氢氧化钠溶液共热的离子方程式为:HCO3-+NH4++2OHˉ
NH3↑+H2O+CO2↑。不会有残留的固体杂质。因此可以采用加热的方法除去NaCl固体中混有少量的NH4HCO3杂质。正确。D.NaOH与NH4HCO3电离产生的阴离子、阳离子均发生反应。故其与足量氢氧化钠溶液共热的离子方程式为:HCO3-+NH4++2OHˉ NH3↑+H2O + CO32-.错误。4HCO3的化学性质的知识。
NH3↑+H2O + CO32-.错误。4HCO3的化学性质的知识。

科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
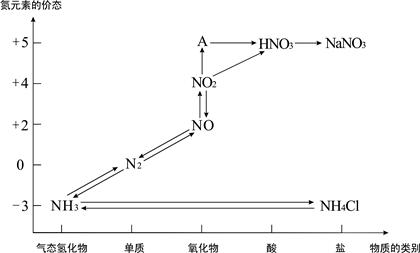
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
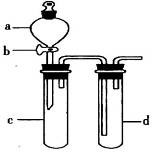
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
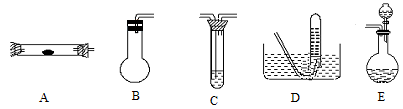
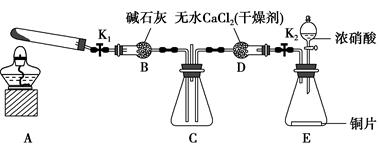
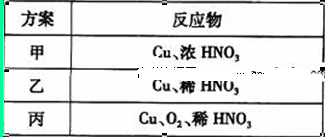
 方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。
方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。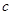 方案制取N2,则氮气中一定混有何种杂质气体 ______________________
方案制取N2,则氮气中一定混有何种杂质气体 ______________________ 方案结合使用越来越受到人们的关注,这种方法与
方案结合使用越来越受到人们的关注,这种方法与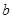 方案相比,其优越性在于____________。
方案相比,其优越性在于____________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
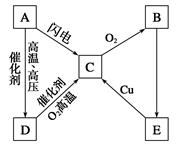
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com