
某有机物键线式的结构为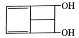 ,关于其说法正确的是
,关于其说法正确的是
A.分子式为C8H10O2
B.可发生氧化、取代、加成反应
C.该有机物的含酯基的芳香族化合物的同分异构体有4种
D.它的另一种同分异构体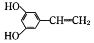 最多有13个原子共平面
最多有13个原子共平面
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届北京市海淀区高三上学期期末化学试卷(解析版) 题型:填空题
H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂。有研究表明,H2O2溶液的漂白性是HO2—所致。
(1) H2O2溶液显弱酸性,测得0.15 mol·L?1 H2O2溶液pH约为6。写出H2O2生成HO2—的电离方程式: 。
(2)其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如下:

由上图可得到的结论是 ,结合平衡移动原理简述理由: 。
(3)实验发现: 若pH >11,则H2O2溶液的漂白效果随pH增大而降低。针对这一现象,继续进行实验,发现溶液中H2O2的分解与pH有关。测定不同初始pH条件下,初始浓度均为0.15 mol·L?1 的H2O2溶液发生分解反应,结果如下:
初始pH | pH = 10 | pH = 12 |
1小时后H2O2溶液浓度 | 0.13 mol·L?1 | 0.07 mol·L?1 |
1小时后pH | 没有明显变化 | 没有明显变化 |
查阅资料:HO2—+H2O2=H2O+O2+OH—。
①结合离子方程式解释1小时后pH没有明显变化的原因: 。
②从反应速率的角度分析pH过大,H2O2溶液漂白效果会降低的原因: 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省深圳市三校高三上学期第一次联考化学卷(解析版) 题型:选择题
某同学通过系列实验探究Al及其化合物的性质,操作正确且能达到目的的是( )
A.将铝片加入浓硫酸中,探究Al的活泼性
B.将NaOH溶液缓慢滴入Al2(SO4)3溶液中,观察Al (OH)3沉淀的生成及溶解
C.将Al (OH)3浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D.将Al (OH)3沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水AlCl3固体
查看答案和解析>>
科目:高中化学 来源:2017届广东省韶关市高三上高考调研理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比6∶7,X的最高正价是W的最低负价的绝对值的2倍。下列说法正确的是
A. X单质可以通过铝热法获得
B. X的氧化物和Z的最高价氧化物化合的产物中有共价键和离子键
C. Y的氧化物是良好的半导体材料
D. Z的氢化物比W的氢化物更稳定
查看答案和解析>>
科目:高中化学 来源:2017届广东省汕头市高三上学期期末化学试卷(解析版) 题型:实验题
高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿制高锰酸钾的流程如下(部分条件和产物省略):
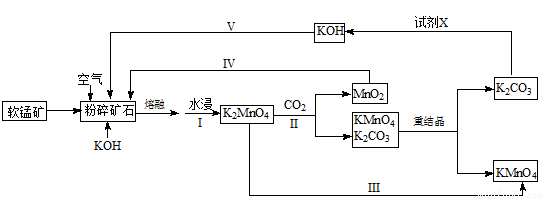
请回答下列问题:
(1)写出KOH的电子式 。
(2)写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式: 。
(3)从经济性考虑试剂X宜选择(填名称): 。上述流程中,设计步骤IV和V的目的是 。
(4)已知:常温下,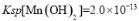 。工业上,调节pH沉淀废水中Mn2+.当pH=10时,溶液中c(Mn2)= 。
。工业上,调节pH沉淀废水中Mn2+.当pH=10时,溶液中c(Mn2)= 。
(5)测定高锰酸钾样品纯度:向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不变色,表明达到滴定终点。写出离子方程式: 。
(6)以惰性材料为电极,采用电解锰酸钾溶液的方法完成步骤III转化。
①阳极反应式为 。
②电解过程中,阴极附近电解质溶液的pH将 (填:增大、减小或不变)。
查看答案和解析>>
科目:高中化学 来源:2017届广东省清远市清城区高三上期末B卷化学试卷(解析版) 题型:实验题
某氯化亚铁和氯化铁的混合物.现要测定其中铁元素的质量分数,按如图步骤进行实验: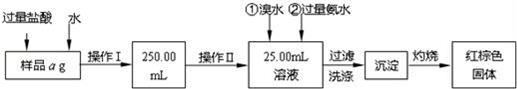
请根据以上流程,回答下列问题:
(1)样品溶解过程中加入少量浓盐酸的目的是什么?
操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有哪些仪器?
操作Ⅱ中可用的玻璃仪器是什么仪器?
(2)请写出加入氨水发生的离子反应方程式。
(3)沉淀洗涤的方法是什么?
(4)将沉淀物灼烧,冷却到室温,用天平称量其质量为b1g,再次灼烧并冷却至室温称量其质量为b2g,若b1﹣b2=0.3g,则接下来还应进行的操作是 .若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 .
查看答案和解析>>
科目:高中化学 来源:2017届广东省清远市清城区高三上期末B卷化学试卷(解析版) 题型:选择题
对于某一已达化学平衡状态的可逆反应,如果改变某种条件,结果使某生成物的浓度增大,则( )
A.平衡一定向正反应方向移动
B.平衡一定向逆反应方向移动
C.反应物的浓度相应减小
D.平衡可能移动也可能不移动
查看答案和解析>>
科目:高中化学 来源:2017届四川省绵阳市高三1月诊断性考试化学试卷(解析版) 题型:选择题
常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示。下列有关叙述正确的是
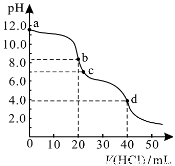
A. a点溶液呈碱性的原因用离子方程式表示为:CO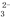 +2H2O
+2H2O H2CO3+2OH-
H2CO3+2OH-
B. c点处的溶液中c(Na+)-c(Cl-)=c(HCO )+2c(CO
)+2c(CO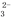 )
)
C. 滴定过程中使用甲基橙作为指示剂比酚酞更准确
D. d点处溶液中水电离出的c(H+)大于b点处
查看答案和解析>>
科目:高中化学 来源:2017届湖南省株洲市高三上教学质检一化学试卷(解析版) 题型:选择题
下列有关离子方程式正确的是
A.将氟气通入水中:F2+ H2O=H++F++HFO
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+=2Fe3++Fe2++4H2O
C.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O=AgOH↓+NH4+
D. 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com