
正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是( )
A.16O与18O互为同位素;H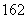 O、D
O、D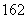 O、H
O、H O、D
O、D O互为同素异形体
O互为同素异形体
B.SiH4、PH3、HCl的稳定性逐渐增强
C.氧化铁的化学式:FeO
D.Ca2+的结构示意图为 ,NH4Cl的电子式为
,NH4Cl的电子式为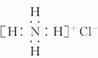
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
有人认为人体是一架缓慢氧化着的“高级机器”,人体在生命过程中也需要不断地补充“燃料”。按照这种观点,你认为人们通常摄入的下列物质不能看作“燃料”的是
A.淀粉类物质 B.纯净水
C.脂肪类物质 D.蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:3A(g)+B(g) 2C(g),在不同温度和压强时A的转化率如表所示。由此
2C(g),在不同温度和压强时A的转化率如表所示。由此
可知,下列图像正确的是
| A的转化率% | P1(Mpa) | P2(Mpa) |
| 200℃ | 89.7 | 76.3 |
| 600℃ | 83.8 | 71.6 |
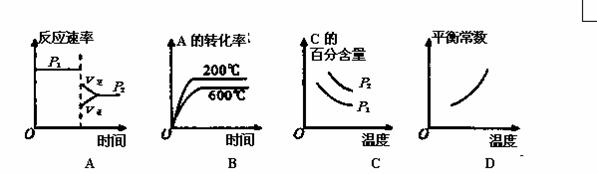
查看答案和解析>>
科目:高中化学 来源: 题型:
向100 mol FeBr2的溶液中,通入3 mol Cl2 。反应后溶液中Br-和Cl-的物质的量浓度相等,则溶液中发生反应的离子方程式为 ( )
A.2Fe2++Cl2 = 2Fe3++2Cl-
B.2Br-+Cl2 = Br2+2Cl-
C.4Fe2++2Br-+3Cl2 = Br2+4Fe3++6Cl-
D.2Fe2++4Br-+3Cl2 = 2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知4种强电解质溶液,分别含有下列阴、阳离子中的各一种,且互不重复:Ba2+、H+、Na+、NH4+、CO32-、NO3-、OH-、SO42-。将这4种溶液分别标记为A、B、C、D,其相互关系如下:①向A或D中滴入C,均有沉淀生成;②A和B反应生成的气体能被D吸收;③A和D反应生成的气体能被B吸收。
请回答下列问题:
(1)A的化学式是 ;C中含有的阳离子是 。
(2)写出下列物质的化学式:B ,D 。
(3)写出A和D反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中可能大量共存的是( )
A、在碱性溶液中:K+、Cl-、Na+、CO32-
B、在c(H+)/ c(OH-)=1×10-12的溶液中:Ca2+、Cl-、K+、NH4+
C、澄清透明溶液中:Cu2+、Fe3+、I-、SO42- ks5u
D、与铝粉反应放出氢气的无色溶液中:K+、NO3-、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,将0.100 0 mol·L-1盐酸滴入20.00 ml 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如右图。下列有关说法不正确的是
A.该一元碱溶液浓度为0.100 0 mol·L-1
B.a、b、c点的水溶液导电性依次增强
C.室温下,MOH的电离常数Kb=1×10-5
D.b点:c(M+)+c(MOH)=c(Clˉ)

查看答案和解析>>
科目:高中化学 来源: 题型:
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:


已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)反应Ⅰ中发生的氧化还原反应的化学方程式为 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是______________________。
(3)反应Ⅱ的离子方程式为 ___。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作____ ____。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)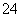 聚合离子。该水解反应的离子方程式为____________________________。
聚合离子。该水解反应的离子方程式为____________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO 。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中各阳离子的浓度相同(不 考虑溶液中离子的变化),且SO42-的物质的量浓度为6mol ,则此溶液最多能溶解铁粉的质量为
,则此溶液最多能溶解铁粉的质量为
A.5.6g B.11.2 g C.22.4g D.33.6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com