
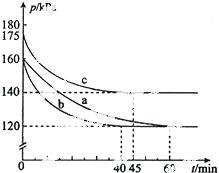
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:分析 (1)根据熔沸点判断出常温下各物质状态,根据生成物与放出热量的关系,计算出反应热,再据此写出热化学方程式;
(2)①根据v=$\frac{△c}{△t}$计算出反应速率;
②根据到达平衡用时的多少可以比较出反应速率的大小;再根据图象中的曲线的变化趋势判断出条件的改变;
③对于气体来讲,压强之比就等于物质的量之比,根据三段式,进而求得转化率的表达式及具体的值;
解答 解:(1)因为AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃,室温时,AX3为液态,AX5为固态,生成1mol AX5,放出热量123.8kJ,该反应的热化学方程为:AX3(g)+X2(g)=AX5(s)△H=-123.8kJ•mol-1,
故答案为:AX3(l)+X2(g)=AX5(s)△H=-123.8kJ•mol-1;
(2)①起始时AX3和X2均为0.2mol,即no=0.4mol,总压强为160KPa,平衡时总压强为120KPa,设平衡时总物质的量为n,根据压强之比就等于物质的量之比有:$\frac{120KPa}{160KPa}$=$\frac{n}{0.4mol}$,n=0.30mol,
AX3(g)+X2(g)?AX5(g)
初始 (mol) 0.20 0.20 0
平衡 (mol) 0.20-x 0.20-x x
(0.20-x)+(0.20-x)+x=0.30
x=0.10
v( AX5)=$\frac{0.10mol}{10L×60min}$=1.7×10-4mol/(L•min),
故答案为:1.7×10-4mol•L-1•min-1
②根据到abc达平衡用时的多少可以比较出反应速率的大小为:b>c>a;
与实验a相比,b实验到达平衡的时间变小,但平衡没有发生移动,所以为使用催化剂;c实验到达平衡时总压强变大,说明平衡逆向移动,而化学反应速率变大,考虑到该反应是放热反应,所以是升高温度所导致的,
故答案为:bca;加入催化剂.反应速率加快,但平衡点没有改变;温度升高.反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大);
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,根据压强之比就等于物质的量之比有:$\frac{Po}{P}$,n=$\frac{0.4P}{Po}$,
AX3(g)+X2(g)?AX5(g)
初始 (mol) 0.20 0.20 0
平衡 (mol) 0.20-x 0.20-x x
(0.20-x)+(0.20-x)+x=n
x=0.40-n=0.4-$\frac{0.4P}{Po}$
α=$\frac{0.4-\frac{0.4P}{Po}}{0.2}$×100%=2(1-$\frac{P}{Po}$)×100%
∴αa=2(1-$\frac{P}{Po}$)=2(1-$\frac{120}{160}$)×100%=50%
αc=2(1-$\frac{140}{175}$)×100%=40%,
故答案为:2(1-$\frac{P}{Po}$)×100%;50%;40%.
点评 本题考查了热化学方程式的书写、化学反应速率、转化率的求算、影响化学反应速率和化学平衡的因素等内容,难度中等,关键是要学生能正确理解压强与物质的量的关系,并由此进行计算,有点难度,容易出错.


科目:高中化学 来源: 题型:解答题
| 成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其他不溶于酸的物质 |
| 质量分数(%) | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23-26 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.009mol•(L•s) -1 | B. | v(CO)=0.009mol•(L•min)-1 | ||
| C. | v(C)=0.00015 mol•(L•s) -1 | D. | v(H2O)=0.09mol•(L•min)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(NO3)3溶液中加入少量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 向Mg(HCO3)2溶液中加入过量NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | |
| C. | 用惰性电极电解饱和食盐水:2Cl-+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| D. | 向苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O═2C6H5OH+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛﹑甲酸甲酯 | B. | 丙烯﹑环丙烷 | C. | 乙酸﹑甲酸甲酯 | D. | 乙烯﹑1-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 钢铁在潮湿的空气中容易生锈 | |
| C. | 工业上生产硫酸的过程中,二氧化硫在接触室氧化时通入过量空气(O2) | |
| D. | 工业合成氨时常用通过量氮气的方法提高氢气的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 4 mol Na2O2在反应中共得到8NA个电子 | |
| C. | 每生成4 mol Fe(OH)3反应过程中共转移电子6 mol | |
| D. | 反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com