
| A. | 6种 | B. | 16种 | C. | 32种 | D. | 12种 |
分析 分子式为C5H12O的醇的种类取决于-C5H11的种类,-C5H11的异构体有8种:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CHCH(CH3)CH2CH3、-C(CH3)2CH2CH3、-C(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3;分子式C4H8O2的酸有2种:CH3CH2CH2COOH、CH3CH(CH3)COOH,据此判断二者形成酯的种类.
解答 解:分子式C4H8O2的酸有2种:CH3CH2CH2COOH、CH3CH(CH3)COOH;
分子式为C5H12O的醇的种类取决于-C5H11的种类,-C5H11的异构体有8种:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CHCH(CH3)CH2CH3、-C(CH3)2CH2CH3、-C(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,则分子式为C5H12O的醇有8种,
所以分子式为C5H12O的醇与C4H8O2的羧酸在浓H2SO4存在时共热生成的酯有:2×8=16种,
故选B.
点评 本题考查了同分异构体数目的计算,题目难度中等,明确“C4H8O2的酸的种类取决于-C3H7的种类,分子式为C5H12O的醇的种类取决于-C5H11的种类”为解答关键,注意掌握同分异构体的书写原则.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
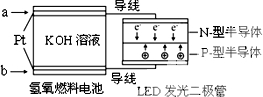 LED产品的使用为城市增添色彩.如图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
LED产品的使用为城市增添色彩.如图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )| A. | 该装置将化学能最终转化为电能 | |
| B. | a处通入O2 | |
| C. | b处为电池正极,发生还原反应 | |
| D. | 通入O2的电极上发生的电极反应为O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
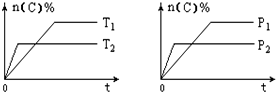 可逆反应aA(g)+bB(s)?cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
可逆反应aA(g)+bB(s)?cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )| A. | 使用催化剂,C的物质的量分数增加 | |
| B. | 升高温度,平衡向正反应方向移动 | |
| C. | 化学方程式的系数a<c+d | |
| D. | 根据图象无法确定改变温度后平衡移动方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
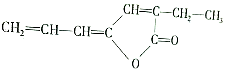 ,该物质在现代工业合成中大有用途,请回答下列有关该物质的问题:
,该物质在现代工业合成中大有用途,请回答下列有关该物质的问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2所含的阴离子数 | |
| B. | 22.4LCO2所含氧原子数 | |
| C. | 2L1mol•L-1硫酸溶液中所含的氢离子数 | |
| D. | 点燃条件下,1molCl2与足量的钠充分反应时转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
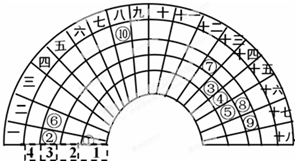 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A. | ⑥、⑧、⑨对应原子的半径依次减小 | |
| B. | ②、⑦的最高价氧化物对应的水化物能相互反应 | |
| C. | 元素⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ①分别与③、④、⑤形成的气态化合物稳定性大小为:⑤>④>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/mn | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 | +1 |
| A. | 元素④气态氢化物的稳定性大于元素⑤气态氢化物的稳定性 | |
| B. | 元素②气态氢化物的沸点小于元素⑤气态氢化物的沸点 | |
| C. | 元素②⑥形成的化合物具有两性 | |
| D. | 元素④的最高价氧化物的水化物比元素⑤的最高价氧化物的水化物酸性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com