
【题目】利用15N可以测定亚硝酸盐对地下水质的污染情况。
(1)下列说法正确的是______。
A.14N与15N为同种核素 B.14N的第一电离能小于14C
C.15NH3与14NH3均能形成分子间氢键 D.14CH315NH2与CH3CH2NH2互为同系物
(2)15N的价层电子排布图为_______,15NH4Cl的晶胞与CsCl相同,则15NH4Cl晶体中15NH4+的配位数为_____;15NH4+中15N的杂化轨道类型为_________。
(3)工业上电解法处理亚硝酸盐的模拟工艺如图:
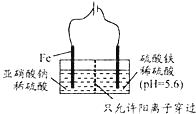
已知:阳极区发生化学反应:2N02+8H++6Fe2+═N2↑+6Fe3++4H2O
①阳极电极反应方程式是______(不考虑后续反应);
②若硫酸溶液浓度过大,阴极区会有气体逸出,该气体为________(填化学式); 该现象表明c(H+)越大,H+氧化性越_______;
③若电解时电路中有0.6mol电子转移,且NaNO2有剩余,则电解池中生成________molNa2SO4。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用以下线路合成有机化合物F:
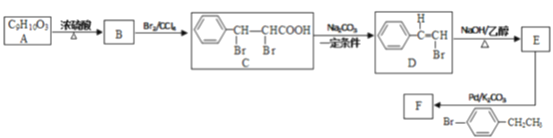
已知:R-C≡CH+R-Br![]() R-C≡C-R+HBr
R-C≡C-R+HBr
(1)B中官能团的名称是______,E的化学名称是_______;
(2)F的结构简式为____,由D生成E的反应类型是_______;
(3)试推断在核磁共振氢谱中A有多少组峰__;
A.8 组 B.9 组 C.7 组
(4)写出C与足量NaOH 溶液在加热条件下反应的化学方程式:____________;
(5)2 分子A在一定条件下反应生成一种含有3个六元环的化合物,该生成物的结构简式为_______ ;
(6) 同时满足下列条件的A 的同分异构体有___种( 不考虑立体异构)。
①属于芳香族化合物;
②能与碳酸氢钠溶液反应生成CO2;
③在一定条件下能发生催化氧化,且其产物能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如下图所示,下列说法一定正确的是
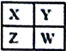
A. 若X元素在自然界中存在同素异形体,则W在同周期元素中,原子半径最小
B. 若HmXOn为强酸,则X 的氢化物溶于水一定显酸性(m、n均为正整数)
C. 若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
D. 若四种元素均为非金属,则Y元素在化合物中不可能显示正化合价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中:①NaCl;②NaOH;③NH3·H2O;④CH3COOH溶液;⑤BaSO4;⑥H2O;⑦HCl;⑧H2SO4;⑨CO2;⑩酒精溶液(均填写编号回答)
(1)pH相等的②的溶液和③的溶液等体积加水稀释相同倍数后,pH大的是______.
(2)有pH均为2的④、⑦、⑧三种物质的溶液,物质的量浓度大到小的顺序为______,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是__________.
(3)某温度时,1mol·L-1的醋酸溶液电离平衡常数为1.0×10-8,达平衡时,溶液中氢离子浓度是______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化合物中,不属于烃的衍生物的有( )
A. CH3CH3 B. CH2=CHCl
C. CH3CH2OH D. CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液
(1)实验测得0.1 mol·L-1一元弱酸HA 的pH为4,则HA的电离平衡常数Ka= ;
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为 ;
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为 ;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是 ;
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中正确的是( )
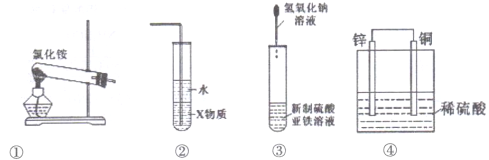
A. 装置①可用于实验室用制取氨气
B. 装置②中X若为四氯化碳,可用于吸收氨气
C. 装置③可用于制备氢氧化亚铁并观察其颜色
D. 装置④是原电池,锌电极为负极,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去):

相关信息如下表所示。
化合物 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 |
TiCl4 | -25 | 136 | 1.5 | 易水解生成难溶于水的物质,能溶于有机溶剂 |
CCl4 | -25 | 76.8 | 1.6 | 难溶于水 |
请回答下列问题:
(1)按照气流由左到右的方向,上述装置合理的连接顺序为a→ → →f→g→ → →d→e→j。(填仪器接口字母)_____________
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;__________(按正确的顺序填入下列操作的序号)。
①关闭分液漏斗活塞 ②打开分液漏斗活塞
③停止加热,充分冷却 ④加热装置D中陶瓷管
(3)装置A中导管m的作用是________________。
(4)装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为______________。
(5)设计实验证明装置E中收集到的液体中含有TiCl4:___________________________________。
(6)制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com