
| A. | 用海水制盐 | B. | 从海水中提取镁 | C. | 从海水中提取溴 | D. | 从海带中提取碘 |
分析 A.海水制盐,利用的是蒸发原理,水与盐类物质分离;
B.海水中镁元素以离子形式存在,提取Mg单质,元素的化合价降低;
C、海水中溴元素以离子形式存在,提取溴单质,元素的化合价升高,属于化学变化;
D、海水中碘元素以离子形式存在,提取碘单质,元素的化合价升高,有新物质生成.
解答 解:A.用海水制取盐,利用蒸发原理使水与盐类物质分离,没有新物质生成,属于物理变化,故A选;
B.海水中镁以镁离子形式存在,先发生复分解反应生成氯化镁,再电解熔融氯化镁提取镁,反应中均有新物质生成,则发生化学变化,故B不选;
C.海水中溴以离子形式存在,从海水中制取溴属于化学变化,故C不选;
D.用海带提取碘单质有新物质碘单质生成,属于化学变化,故D不选;
故选A.
点评 本考点考查了物理变化和化学变化的区别,基础性比较强,只要抓住关键点:是否有新物质生成,问题就很容易解决.本考点主要出现在选择题和填空题中.


科目:高中化学 来源: 题型:解答题
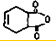 一种生产除虫剂胺菊酯的重要原料,其合成路线如下:
一种生产除虫剂胺菊酯的重要原料,其合成路线如下: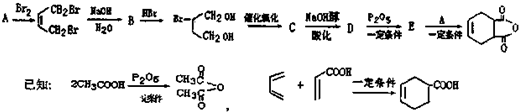
 ,A的系统命名为1,3-丁二烯;
,A的系统命名为1,3-丁二烯; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(H2)/mol | n(I2)/mol |
| 0 | 0.9 | 0.3 |
| t1 | 0.8 | |
| t2 | 0.2 |
| A. | 反应在t1 min内的平均速率为:v(H2)=$\frac{0.1}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变 | |
| C. | 保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时n(HI)=0.2 mol | |
| D. | 升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
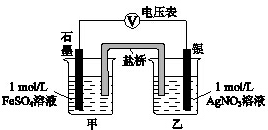 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3溶液加入到 1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lH、2H、3H为同素异形体 | B. | lH、2H、3H互为同位素 | ||
| C. | lH、2H、3H的质量数相同 | D. | lH、2H、3H为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C2H4和C2H20一定互为同系物 | |
| B. | 丙氨酸和苯丙氨酸脱水缩合,最多可生成3种二肽 | |
| C. | 葡萄糖在人体内被氧化,最终转化为二氧化碳和水,并释放能量 | |
| D. | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,有沉淀析出,再加水沉淀会溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
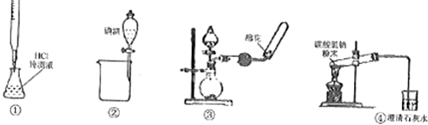
| A. | 利用装置①进行盐酸待测溶液浓度的测定 | |
| B. | 利用装置②分离碘酒中碘和酒精 | |
| C. | 利用装置③制备收集干燥氨气 | |
| D. | 利用装置④加热分解碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
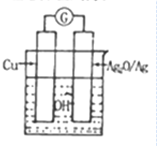 普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性.根据这一特点,科学家发明了电动势(E)法则水泥初凝时间,此法原理如图所示.反应总方程式为:2Cu+Ag2O═Cu2O+2Ag.
普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性.根据这一特点,科学家发明了电动势(E)法则水泥初凝时间,此法原理如图所示.反应总方程式为:2Cu+Ag2O═Cu2O+2Ag.| A. | 工业上制备水泥的原料有黏土、石灰石、石膏 | |
| B. | 测量原理装置图中Ag2O/Ag极发生还原反应 | |
| C. | 负极的电极反应式为2Cu+H2O-2e-=Cu2O+2H+ | |
| D. | 在水泥固化过程中,由于自由水分子的减少,溶液中各离子浓度的变化导致电动势变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| B. | 溶液中含大量Al3+:HClO、HCO3-、ClO-、CO32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 中性的溶液中:CO32-、Na+、SO42-、AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com